 |
Черные дыры в Российском Законодательстве 2002'4
|
|
|
СУДЕБНАЯ ЭКСПЕРТИЗА
Разработка проблемы судебно-медицинской генетической идентификации
Перепечина И.О., к.м.н., доцент, судебно-медицинский эксперт высшей
категории,
ведущий научный сотрудник
Российский центр судебно-медицинской экспертизы Минзрава РФ
Введение
Идентификационное исследование объектов биологического просхождения
основывается на изучении генетически обусловленных признаков различной природы.
В 1900 году К. Ландштейнером была открыта первая генетически обусловленная
полиморфная система человека - АВО. В дальнейшем стали известны десятки других
маркеров генетического полиморфизма - эритроцитарных, сывороточных, ферментных.
Открытие в начале 1980-х годов гипервариабельных локусов ДНК [1,2] явилось
научным фундаментом для использования в дальнейшем полиморфизма этих локусов для
идентификационных целей. В 1985 году Jeffreys A.J. и соавт. обнаружили в геноме
человека высокополиморфное семейство минисателлитных маркеров и впервые
высказали идею о том, что изучение полиморфизма гипервариабельных локусов может
иметь значение для судебной медицины [3,4]. Аналогичный полиморфизм, но на
основе других семейств повторов ДНК, был обнаружен в 1986 году Рогаевым Е.И.
[5], а затем рядом других исследователей [6,7]. Ключевым для судебной медицины
вопросом явилась показанная в 1985 году Gill P. и соавт. возможность применения
ДНК-анализа для исследования измененного биологического материала - сухой крови,
выделений и других объектов судебно-медицинской экспертизы [8]. В России
исследование идентификационных ДНК-маркеров было впервые освещено в работах
[9-12].
Первые этапы нашей работы в области генетической идентификации личности были
связаны с изучением новых возможностей для эффективного анализа
изосерологических полиморфных маркеров. С этой целью была проведена разработка
экспертной методологии применения в экспертизе вещественных доказательств нового
класса группоспецифических иммунореагентов - моноклональных антител, не
изученных ранее в судебно-медицинском аспекте. Был выполнен также ряд других
исследований, в ходе которых были предложены высокочувствительные и специфичные
методы выявления групповых изоантигенов. Эксперименты охватили широкий спектр
генетических эритроцитарных систем - АВО, Rh, MNSs, P, Lewis, Kell, Duffy.
В 1988 году область исследований была расширена, включив в себя также
изучение вопросов идентификации личности методами анализа ДНК. Работа
проводилась в рамках научно-исследовательской программы МВД РФ по разработке
генотипоскопии как нового направления экспертизы вещественных доказательств с
целью внедрения новых методов в практику судебной экспертизы. Инициаторами и
организацторами этой программы являлись: к.м.н., полковник милиции, начальник
отдела экспертиз биологических объектов ЭКЦ МВД РФ Стегнова Т.В., к.ю.н.,
генерал-майор милиции, начальник ЭКЦ МВД РФ Статкус В.Ф., научным консультантом
был зав. лабораторией молекулярной генетики мозга научного центра психического
здоровья РАМН, д.б.н. Рогаев Е.И. До 1999 года наши исследования выполнялась в
Экспертно-криминалистическом центре МВД РФ, в дальнейшем - в Российском центре
судебно-медицинской экспертизы МЗ РФ.
Учитывая, что исследование началось на самом раннем этапе разработки
ДНК-идентификации, выполнение поставленной задачи потребовало изучения целого
комплекса вопросов.
1. РАЗРАБОТКА МЕТОДИЧЕСКИХ ВОПРОСОВ ИССЛЕДОВАНИЯ ИДЕНТИФИКАЦИОННЫХ
ГЕНЕТИЧЕСКИХ МАРКЕРОВ (Экспериментальные и экспертные исследования)
Полный комплекс наших исследований включал изучение идентификационных
изосерологических и ДНК-маркеров. Ниже будет представлена та часть работы,
которая относилась к изучению маркеров, исследуемых молекулярно-генетическими
методами (ДНК-маркеров). Исследования представлены с учетом хронологии,
поэтапно, с тем, чтобы показать, как реально шла разработка данного направления.
Проведенные исследования носили сугубо прикладной, судебно-медицинский
характер и для оценки их результатов важно понимание того, чем экспертные
методики кардинально отличаются от молекулярно-генетических (или иных) методов.
Отличаются они, прежде всего, своей концептуальной стороной - закрепленным в
экспертной методике выбором того или иного способа исследования из арсенала
имеющихся или возможных в молекулярной генетике. Это предполагает от
разработчика экспертной методики взятие ответственности за то, что рекомендуемый
способ: (а) пригоден для использования его в данном экспертном исследовании, (б)
целесообразен, (в) оптимизирован с учетом особенностей объекта этого
исследования, (г) отвечает требованиям, предъявляемым к методикам, применяемым
при исследовании вещественных доказательств. В соответствии с этим, разработка
экспертной методики требует изучения особых аспектов и границ применения метода,
не проводившегося при его разработке для целей молекулярной генетики. Кроме
того, экспертная методика не ограничивается техникой анализа ДНК, включая такие
специфические для экспертизы вопросы, как методические подходы к исследованию в
зависимости от характера объектов, особенности интерпретации в различных
экспертных случаях, способы представления хода и результатов исследования в
заключении эксперта, формулировки выводов и т.д.
1.1. Материал и методы исследования
Экспериментальные образцы биологического материала. Исcледовано 560 образцов
жидкой и сухой крови, слюны, спермы и вагинальных выделений человека. Подбор
образцов крови и выделений осуществляли таким образом, чтобы он отражал
особенности судебно-медицинских объектов.
Кровь. Жидкая кровь (164 образца). Образцы были представлены: 1) в нативном
виде (без антикоагулянтов); 2) в растворе антикоагулянтов: 0,02 М ЭДТА, 1 х SSC
и др. Исследовали кровь, взятую из вены и из пальца. Пятна крови (178 образцов).
Образцы сухой крови получали высушиванием крови на марле и различных
предметах-носителях. Пятна готовили путем нанесения крови на ткань
непосредственно после ее взятия, а также из свернувшейся крови. Образцы хранили
при температуре 20-250С открыто на столе двое суток, затем - в бумажных пакетах
при комнатной температуре и температуре –200С. В исследования также включали
образцы крови, имеющей гнилостные изменения различной степени выраженности.
Слюна (36 образцов). Пятна готовили путем нанесения жидкой нативной слюны на
предмет-носитель; исследовали также буккальный эпителий, взятый в виде соскоба
на ватный тампон или специальный шпатель; следы слюны на окурках, марках,
жвачке.
Сперма (78 образцов). С целью изучения возможного влияния на результаты
проведения этапов ДНК-анализа патологических изменений спермы часть коллекции
(50 образцов) составляли образцы с известной спермограммой; имелись также
образцы крови тех же лиц. Пятна спермы готовили на различных
предметах-носителях. В качестве последних использовали, в том числе,
предметы-носители, оставшиеся после проведения экспертиз. Некоторые из них имели
микробную загрязненность, что устанавливали по цитологическим (выраженная
обсемененность микрофлорой при окрашивании препарата гематоксилин-эозином) и
иным признакам.
Вагинальные выделения (54 образца). Образцы вагинальных выделений получали от
лиц, обращавшихся в медицинские учреждения, в том числе, по поводу
гинекологических заболеваний воспалительного характера. Исследовали также кровь
этих лиц.
«Смешанные» следы (50 образцов). В связи с тем, что следы, изучаемые в
экспертной практике, часто являются "смешанными", готовили и исследовали
соответствующие экспериментальные образцы, содержащие кровь и выделения в
различных их сочетаниях: кровь 2-х лиц, кровь + сперма, кровь + вагинальные
выделения, сперма + вагинальные выделения, кровь + сперма + вагинальные
выделения, сперма 2-х лиц + вагинальные выделения.
Исследовали также образцы различных тканей - мышечной, мозговой, хрящевой,
костной; фрагменты печени, селезенки, почек; волосы.
Методы исследования: комплекс методов выделения ДНК из биологического
материала; ПДРФ- и ПЦР-анализ полиморфных локусов и маркеров половых хромосом. В
необходимых случаях использовались иммунологические, цитологические и иные
методы.
1.2. Исследование
Новизна и малая изученность проблемы требовала разработки всего экспертного
методического комплекса, начиная с первых этапов работы с экспертным
биологическим материалом.
Определение предпочтительных способов взятия и хранения биологического
материала для ДНК-анализа; изучение сохраняемости ДНК в следах биологического
происхождения
С целью разработки для следователей и выезжающих на места происшествия
экспертов рекомендаций по изъятию биологических объектов и их транспортировке, а
также по организации работы с биологическим материалом в экспертных лабораториях
ДНК-анализа, были изучены вопросы его взятия и хранения. Устанавливали, какое
количество крови необходимо для исследования, обязательно ли использование
антикоагулянтов; изучали влияние на состояние ДНК различных режимов хранения
крови. В дальнейшем эти вопросы рассматривались также применительно к проблеме
создания банков ДНК. Здесь мы приведем только некоторые из наших наблюдений.
Следы крови. Для изучения сохраняемости ДНК в следах крови исследовали
различные экспериментальные образцы: пятна, изготовленные в лаборатории из крови
живых лиц, следы трупной крови, кровь живых лиц, искусственно подвергшуюся
гниению. Следы крови хранили при разных температурных режимах: при комнатной
температуре (20-24оС), при температуре холодильника (4-6оС), в замороженном
состоянии (при температуре –18-20оС). Сделанные наблюдения позволили выявить
характер изменения состояния ДНК в различных типах образцов в зависимости от
сроков и температуры хранения, а также выработать рекомендации по хранению
следов крови:
- Количество и состояние ДНК, выделенной из следов крови, в значительной
степени определяются состоянием ДНК перед образованием следов. Оптимальным
является, если следы готовят непосредственно при взятии крови. Если перед
изготовлением пятен кровь хранилась в жидком состоянии, качество ДНК в следах
хуже. Поэтому целесообразно, по возможности, готовить следы непосредственно
при взятии крови.
В следах, образованных трупной кровью, деградация ДНК имеется уже изначально и
обычно более выражена. Такая же картина наблюдается и с образцами крови живых
лиц, искусственно подвергшейся гниению.
- Если при изготовлении следов кровь в хорошем состоянии, то при хранении
таких следов при комнатной температуре в течение первых трех месяцев после их
образования ДНК обычно выделяется лишь с незначительными признаками
деградации: существенная ее часть сосредоточена в высокомолекулярной области и
частично деградирована до фрагментов размерами 0,3-20 kb. Такое состояние ДНК
удовлетворяет требованиям ее анализа и позволяет рекомендовать направление на
экспертизу сравнительных образцов в высушенном виде, без обязательного
предоставления жидкой крови. Транспортировка крови в жидком виде имеет
недостатки: (а) техническое неудобство (кровь может разлиться, пробирка или
флакон - разбиться); (б) сроки транспортировки нередко оказываются большими,
чем предполагается; в этих случаях кровь в следах может сохраниться лучше, чем
в жидком виде.
- Если следы готовят непосредственно после взятия крови, сразу их
замораживают и не подвергают повторному размораживанию, ДНК выделяется в
достаточно хорошем состоянии и при длительных сроках хранения. При
необходимости длительного хранения следы крови следует замораживать,
предварительно разделяя их на несколько частей.
Сперма:
- Деградация ДНК в жидкой сперме происходит несколько быстрее, чем в крови,
что, видимо, связано с большим микробным загрязнением спермы за счет большего
содержания в ней белка и присутствия в ней микрофлоры нередко уже in vivо.
Поэтому в тех случаях, когда на исследование представляется сперма в жидком
виде, ее следует высушивать как можно скорее.
- Процессы деградации в следах спермы также идут несколько быстрее, чем в
следах крови. На возможности последующего исследования это, в целом, не
отражается, что, видимо, объясняется большим содержанием ДНК в сперме, чем в
крови, и связанным с этим большим абсолютным содержанием фрагментов
необходимой величины.
- При выборе режимов хранения образцов следует учитывать не только
устойчивость ДНК, но и факторы, связанные с проведением экспертизы. Так,
хранение следов спермы в замороженном виде приводит к разрушению
сперматозоидов и невозможности из-за этого впоследствии проводить
цитологическое исследование, которое обычно необходимо. Поэтому помещать
следы, содержащие сперму, в морозильную камеру, по крайней мере, до окончания
исследования не следует.
Ткани и фрагменты органов:
- При поступлении объектов в лабораторию следует безотлагательно выделить
ДНК и проверить ее количественное и качественное состояние. Если оно
удовлетворительное, оставшуюся часть образцов целесообразно сразу заморозить.
Если нет, то выделение ДНК провести повторно, после чего заморозить образцы.
- В связи с быстрым изменением тканей и органов, весьма актуален вопрос об
условиях транспортировки этого материала. Наилучшие условия хранения
обеспечиваются в замороженном состоянии, однако, размораживание материала (в
особенности – неоднократное) неблагоприятно сказывается на состоянии ДНК.
Поэтому следователи, организовывая транспортировку этих объектов, должны
учитывать, что замораживание образцов целесообразно только при условии, что
материал в дороге не размораживается. Если это обеспечить нельзя, то
рекомендуется транспортировать образцы без замораживания, но в охлажденном
состоянии.
Изучение вопросов выделения ДНК из биологического материала
Протоколы выделения ДНК имелись в литературе уже на самом раннем этапе
разработки ДНК-анализа в судебной медицине [8,13], поэтому работа касалась
изучения оптимальных условий применения этих методов. При отработке техники
выделения ДНК рассматривали возможности использования минимальных количеств
биологического материала, наилучшей его очистки, сокращения сроков исследования.
При исследовании фенольным методом жидкой крови варьировали: (1) количество
крови: (а) 2 мл, (б) 1 мл, (в) 500 мкл, (г) 200 мкл, (д) 100 мкл; (2) способы
проведения лизиса: (а) применение однократной (двукратной, трехкратной)
обработки сахарозным буфером с последующим отмыванием и добавлением
дигестирующего раствора, (б) без использования сахарозного буфера -
непосредственно добавляя дигестирующий раствор к крови; (3) пропорцию
сахарозного буфера и крови: (а) 1:9, (б) 1:5, (в) 1:1; (4) состав дигестирующего
буфера: (а) 0,075 M NaCl, 0,024 M ЭДТА, 1-2% SDS; (б) 10 mM трис-HCl, pH 7,5, 10
mM ЭДТА, 5 mM NaCl, 1-2% SDS; (5) протеолитический фермент: (а) протеиназу К,
(б) проназу Е; (6) сроки инкубации с лизирующими агентами: (а) 30 мин, (б) 1 ч,
(в) 3 ч, (г) 8-20 ч; (7) температуру инкубации: (а) 37оС, (б) 45оС, (в) 56оС;
(8) количество протеиназы К (конечная концентрация): (а) 100-150 мкг/мл, (б) 300
мкг/мл, (в) 500 мкг/мл; (8) режимы центрифугирования: (а) с использованием
макроцентрифуги: 4-6 об/мин (с охлаждением) 10-15 мин; (б) с использованием
микроцентрифуги: 10 и 15 тыс. об/мин: 1 мин, 2 мин, 5 мин; (9) способ фенольного
экстрагирования: (а) равные объемы: фенола, фенола / хлороформа (1:1),
хлороформа; (б) двукратно – фенолом, однократно – хлороформом; (в) двукратно –
смесью фенола/хлороформа (1:1); (10) концентрации NaCl: (а) 0,1 М, (б) 0,2 М,
(в) 0,5 М; ацетата натрия; (11) использование для растворения ДНК: (а)
деионизованной воды, (б) ТЕ, (в) TES.
Учитывая, что методы предназначались для широкого внедрения в экспертную
практику, мы также изучали те явления, которые могут наблюдаться при изменении
параметров, определяли допустимый диапазон их вариаций. Это было важно для того,
чтобы оценить возможные последствия отступлений от протоколов и сделать при
обучении экспертов акцент на наиболее существенных моментах. К числу таких
ожидаемых отступлений относились, в частности, пролонгирование какого-либо этапа
метода (например, сроков инкубации), прерывание метода на одном из промежуточных
этапов и т.д. Это было связано с реальными условиями работы экспертов, не всегда
позволяющими провести длительную процедуру до конца (например, при необходимости
срочного выезда на место происшествия). Пытаясь предвидеть возможные нарушения
процедуры, мы целенаправленно изучали те явления, которые могли произойти за
счет: (а) существенного пролонгирования сроков лизиса, (б) пролонгирования этапа
контакта с фенолом, (в) неполного удаления фенола, (г) растворения недосушенной
ДНК, (д) пересушивания ДНК, (е) захватывания интерфазы, - предупреждая экспертов
на стажировках о неблагоприятных последствиях этих нарушений.
При отработке техники выделения ДНК из пятен крови варьировали те же
параметры, что и при исследовании жидкой крови (концентрацию протеиназы К, сроки
и температуру инкубации, состав лизирующего буфера, варианты фенольного
экстрагирования, конечные этапы процедуры). Кроме того, изучали эффективность
выделения ДНК при разном количественном соотношении материала и лизирующего
буфера (избытке, недостатке). Как правило, предмет-носитель после инкубации
удаляли, проводя далее обработку фенолом. В некоторых сериях опытов процедуру
экстрагирования фенолом выполняли вместе с предметом-носителем, что явилось
нежелательным, так как влекло за собой худшую очистку материала. Еще одним
вариантом исследования было экстрагирование крови дистиллированной водой или
физраствором в течение 1-18 ч, отсасывание супернатанта и дальнейшее его
исследование, аналогичное тому, какое проводилось при исследовании жидкой крови.
Хотя этот способ обеспечивал хорошую очистку ДНК, его недостатком являлось
снижение выхода ДНК. Выделенную ДНК в ряде случаев подвергали очистке с помощью
диализа. Использовали также очистку и концентрирование ДНК с помощью Centricon
100, ионно-обменные колонки.
Качество «размачивания» пятна является ключевым моментом процедуры, от
которого во многом зависят выход ДНК и ее очистка. Наиболее простым способом
улучшения растворимости пятна и повышения эффективности лизиса является
постоянное, в течение всего срока инкубации, перемешивание смеси при нужной
температуре во время экстрагирования с помощью шейкеров или качающихся платформ,
в режиме, обеспечивающем эффективное пропитывание материала экстрагирующим
раствором при щадящем механическом воздействии.
Исследование следов спермы выполняли, как правило, с выделением клеточного
осадка. В ряде экспериментов (когда дифференциальный лизис не проводили)
инкубирование спермы с ДТТ выполняли без предварительного выделения клеточного
осадка, добавляя в этом случае лизирующую смесь непосредственно к вырезке со
следами спермы и проводя исследование, как описано выше. Использовали также
технику с применением саркозила.
Исследуя фрагменты костей, изучали возможности и предпочтительные способы
выделения ДНК из таких объектов. Исследовали костную ткань и остатки на ней
мягких тканей (например, хрящевой). Измельчение в порошок костной ткани
проводили с помощью стоматологического бора, следя за тем, чтобы он не
перегревался, что могло бы отрицательно сказаться на состоянии ДНК. Важным
фактором для выхода ДНК являлось полноценное перемешивание материала при
инкубации с лизирующим раствором.
Эксперименты по отработке оптимальных протоколов выделения ДНК проводили и в
отношении других судебно-медицинских объектов.
С целью поиска альтернативы фенольному методу, испытывали различные варианты
нефенольных методов: перхлоратного, метода с использованием Chelex, с
применением неионного детергента NP 40, абсорбции ДНК на носителе с последующим
ее элюированием и др. Сравнительный анализ преимуществ и недостатков этих
методов проводился с учетом: (1) количества выделенной ДНК; (2) способности ДНК
к амплификации; (3) сохраняемости проб выделенной ДНК; (4) длительности и
трудоемкости процедуры экстрагирования; (5) необходимости использования
токсических веществ; (6) риска контаминации.
Полученные результаты были отражены в методических документах МВД РФ [14-16].
Изучение вопросов, связанных с хранением
выделенной ДНК
Вопрос о хранении выделенной ДНК был актуален как для экспертизы, так и в
связи с разработкой в дальнейшем проблемы формирования банка ДНК. Применительно
к последней изучаемые аспекты имели здесь ту особенность, что рассматривались
значительные временные интервалы - большие, чем это имеет значение для
экспертной практики. Нас также интересовало, как хранится ДНК, выделенная из
следов, расположенных на реальных предметах-носителях и изначально имеющих
загрязненность.
Устойчивость к хранению для ДНК, выделенной разными способами, различна.
Фенольный метод давно применяется в молекулярной генетике и исследователям
известно, что выделенную этим способом ДНК можно хранить длительное время. В
нашей коллекции ряд проб ДНК, выделенной фенольным методом, хранились 10 лет, по
истечении которых состояние ДНК практически не изменилось: если ДНК изначально
была высокомолекулярной, то она не имела признаков деградации и через 10 лет.
Это подтвердило пригодность фенольного метода выделения ДНК для создания банков
ДНК. Мы также отметили, что важным условием для хранения ДНК, выделенной из
экспертных объектов, является хорошая ее очистка при выделении. Пробы ДНК,
предназначенные для длительного хранения, хранилась в условиях морозильной
камеры при температуре -18оС. На выделенной ДНК повторные размораживания
сказывались значительно меньше, чем на ДНК в следах или тканях. По сравнению с
ДНК, выделенной фенольным методом, ДНК, выделенная с использованием Chelex,
обладала более низкой устойчивостью к хранению.
Изучение вопросов применения ПДРФ-анализа для
исследования судебно-медицинских объектов
Актуальным вопросом являлось изучение реального потенциала ПДРФ-анализа для
судебной медицины, который в указанный период еще не был установлен.
Использованная техника ПДРФ-анализа описана в методических рекомендациях
[14]. Для исследования экспертного материала предпочтительными являлись
монолокусные зонды. Для того чтобы получить в эксперименте общую картину
возможностей ПДРФ-анализа, была исследована панель, состоявшая из следов крови и
спермы со сроками образования от 3-х месяцев до 2-х лет. Наряду с образцами
живых лиц, панель включала в себя и пятна трупной крови. Выход ДНК, достаточный
для проведения идентификационных исследований, был получен из пятен давностью
примерно до полугода, если следы были насыщенными и имели достаточно большие
размеры. ДНК в следах такой давности была частично деградирована с сохранением
фракции высокомолекулярных фрагментов; в Нае III-рестриктах отмечались
Y-специфичные фрагменты слабой интенсивности. Увеличение срока хранения вело к
развитию более выраженной деградации; картина гибридизации становилась трудно
читаема ввиду слабой интенсивности и нечеткости аллельных сигналов, либо не
пригодной для анализа совсем из-за их отсутствия. В образцах трупной крови
деградация ДНК была более выражена и развивалась раньше.
Кроме того, применение ПДРФ-анализа требовало большого количества материала.
К началу исследования мы располагали данными лаборатории молекулярной генетики
мозга НЦПЗ о том, что для получения высококачественной картины гибридизации с
мультилокусными маркерами необходимо 4-7 мкг ДНК, с монолокусными маркерами -
1-4 мкг ДНК. Экперименты показали, что такое количество требует наличия следов
размерами 1-3 см, причем речь идет о модельных образцах с малой давностью
образования следов; в случае ненасыщенных пятен, а также следов с более
длительными сроками хранения, необходимое количество материала могло быть еще
больше.
Это свидетельствовало о том, что ПДРФ-анализ эффективен только для
исследования малоизмененного материала, причем достаточно больших его количеств,
что существенно ограничивало перспективы его применения в экспертной практике.
Кроме того, внедрению метода в широкую экспертную практику препятствовала бы
техническая сложность метода, главным образом, необходимость использования
изотопов (при нерадиоактивном мечении зондов чувствительность его была ниже),
что требовало особых условий для его осуществления. Однако такие условия, как
показал опыт, весьма сложно полноценно обеспечить даже в центральных
научно-исследовательских лабораториях, не говоря уже о региональных практических
подразделениях. Таким образом, метод обещал быть "элитарным" и иметь весьма
ограниченный диапазон применения в экспертизе.
Этот вывод был сделан нами уже на ранних этапах работы и послужил причиной
того, что в 1990 году нами были начаты исследования с использованием
полимеразной цепной реакции (ПЦР). В описываемый период ни в зарубежной, ни в
отечественной литературе подобный вывод в отношении ПДРФ-анализа еще нигде не
фигурировал.
Разработка методов ПЦР-анализа судебно-медицинских
объектов
Первый опыт использования полимеразной цепной реакции для исследования
судебно-медицинских объектов описан в 1987-1988 годах в работах по типированию
локуса HLA-DQA1 [17,18]. Эти крайне важные и многообещающие исследования имели,
однако, пока весьма ограниченное практическое применение, поскольку перспективы
для развития ПЦР-анализа могли обеспечить только разработки в области и
исследования гипервариабельных локусов.
Поэтому в то время, когда началась наша работа по ПЦР, актуальным являлось
изучение, прежде всего, самой возможности применения этой реакции в судебной
медицине. Первые молекулярно-генетические исследования по амплификации
последовательностей VNTR-локусов были опубликованы лишь 1988-1990 годах [19-22].
Несмотря на начатые в разных странах разработки [12,23,24], отношение к
использованию ПЦР в судебной медицине оставалась весьма осторожным в течение
весьма длительного времени. Так, в фундаментальном американском руководстве по
ДНК-анализу 1992 года [25] ПЦР было отведено еще весьма немного места, и даже в
следующей версии этого руководства, изданной в 1996 году [26], в качестве
основной технологии ДНК-идентификации по-прежнему рассматривался ПДРФ-анализ, а
ПЦР фигурировала лишь в качестве нового перспективного метода. Официальная
регламентация ПЦР в системе Минздрава РФ была осуществлена только в 1999 году
[27].
Таким образом, 1990 год – это еще самое начало исследований по ПЦР в судебной
медицине. И необходимо решить, прежде всего, главный вопрос: пригодна ли ПЦР в
качестве базисной технологии исследования судебно-медицинских объектов. В случае
же положительного ответа на этот вопрос - разработать экспертные методики
ПЦР-анализа и определить их место в экспертизе.
Разработка и применение экспериментальной
стратегии
Для изучения методических вопросов исследования разных локусов была
разработана следующая стратегия: (1) Оптимизация метода применительно к
исследованию судебно-медицинских объектов. (2) Изучение артефактов, потенциально
возможных при проведении данного вида исследования. (3) Определение допустимого
диапазона вариаций условий выполнения исследования и изучение последствий его
изменения (с тем чтобы предвидеть последствия отступлений от методик при
внедрении метода в практику). (4) Валидационные исследования: изучение
результатов и особенностей исследования в условиях влияния факторов, характерных
для экспертной практики (загрязнение объектов, малое количество, гетерогенность
и др.). Систематизация соответствующих методических подходов. (5) Разработка
этапов экспертизы и их регламентация в методических документах. (6) Оценка
судебно-медицинского значения разных методов и их вариантов применительно к
решению конкретной экспертной задачи. (7) Определение места метода в экспертном
комплексе в целом.
Удельный вес каждой из этих позиций в разработке для разных маркеров был
различен. Это определялось актуальностью решения той или иной задачи в каждом
случае. На основе результатов исследований были сформированы научные и
методические положения, использованные при внедрении методов в экспертную
практику. Мы подробно опишем эту стратегию применительно к исследованию
амелонениового гена, поскольку ее использование позволило не только изучить
данный генетический маркер, но и сделать вывод о пригодности ПЦР для
исследования реальных судебно-медицинских объектов (этот вывод был также
подтвержден результатами проведенных параллельно исследований полиморфных
локусов - п. 5.3).
Использование ПЦР для установления половой
принадлежности объектов судебно-медицинской экспертизы
Разработка техники исследования
Необходимые для ПЦР компоненты получали из разных источников. Праймеры
синтезировали в фирме "Ясенево", на основе задаваемых последовательностей [28].
Разработанная методика изложена в статье [29] и методических рекомендациях МВД
РФ [30].
Выбранные нами условия ПЦР имели отличия от описанных Nakahori Y. и соавт. В
частности, японские авторы использовали трехфазный цикл амплификации, однако, по
нашему мнению, двухфазный цикл в судебно-медицинских исследованиях обеспечивал
лучшие результаты. При исследовании малых количеств ДНК важным моментом являлось
проведение конечной ренатурации, которая составляла не менее 8 мин.
Разработанная методика позволила получать четкую картину определения пола в
эксперименте, а впоследствии и при исследовании объектов судебно-медицинской
экспертизы: амплифицированные фрагменты имели достаточную интенсивность, профиль
мужской ДНК отличался сбалансированностью Х- и Y-специфичных фрагментов,
артефактная активность отсутствовала. Положительным моментом для экспертного
применения явилось то, что четкая, хорошо читаемая картина амплификации
получалась и в случае, если введенные в ПЦР количества матрицы ДНК несколько
различались.
Изучение специфичности результатов ПЦР
а) Проверка специфичности на панели образцов. Использование методики для
исследования панели проб ДНК, выделенной из 50 образцов жидкой крови лиц
известного пола, показала, что во всех случаях выявления профиля ДНК результат
амплификации женской ДНК представляет собой единичный фрагмент размерами 977
п.о., мужской ДНК - сочетание двух фрагментов - размерами 977 и 788 п.о. Ни в
одном из исследованных образцов мужской ДНК генетический профиль не выявлялся в
виде единичного фрагмента Х-хромосомы и ни в одном из образцов женской ДНК не
обнаруживался Y-специфичный фрагмент.
б) Проверка специфичности в условиях исследования малых количеств ДНК и ее
деградации. Судебно-медицинская методика анализа ДНК должна предусматривать
правильность получения результата в условиях исследования малого количества ДНК
и ее деградации, актуальных для экспертной практики. Такое состояние объекта
может повлечь за собой преимущественную амплификацию, ведущую к
несбалансированности аллельных сигналов у гетерозиготы или полному «выпадению»
фрагмента. Применительно к маркеру пола значение имело бы «выпадение»
Y-специфичного фрагмента, что вело бы к ошибочному установлению женского профиля
вместо мужского («выпадение» Х-специфичного фрагмента к неправильной диагностике
бы не приводило). Учитывая, что амплифицируемый участок Y-хромосомы значительно
более короткий, чем участок Х-хромосомы, и поэтому обладает более высокой
способностью к амплификации, априори "выпадения" Y-специфического фрагмента не
ожидалось. Тем не менее, мы получили этому и экспериментальное подтверждение,
целенаправленно изучив на предмет преимущественной амплификации характер профиля
мужской ДНК при малых концентрациях ДНК, а также ее деградации. Результаты серий
экспериментов (а) и (б) позволили заключить, что метод обеспечивает возможность
категорического заключения о происхождении исследуемой ДНК как от лица мужского,
так и женского генетического пола (особым случаем являются "смешанные" следы –
см. далее).
в) Изучение артефактов. Амплификационный профиль маркирующего генетический
пол сегмента амелогенинового гена характеризуется строго определенной
локализацией Х- и Y-специфичных фрагментов, которые легко идентифицируются. Тем
не менее, мы изучили, какой характер артефактов, принципиально, характерен для
данного генетического маркера.
При проведении исследования в выбранных условиях артефактная активность
отсутствовала. При отклонениях условий ПЦР от оптимальных, в случае появления
артефактов, они не являлись значимыми для интерпретации. При исследовании
судебно-медицинских объектов не всегда удается полностью уравнять вводимые в ПЦР
количества ДНК (особенно в условиях ее деградации), поэтому отметили, как это
может сказаться на амплификационном профиле. Как правило, в таких случаях
картина амплификации оставалась «чистой». При существенном превышении количества
вводимой в ПЦР матрицы выявлялись экстра-фрагменты, которые, однако, не
затрудняли интерпретацию, поскольку локализовались выше или ниже Х- и
Y-специфичных фрагментов и, к тому же, были значительно менее интенсивны.
Прицельно изучая эти экстра-фрагменты, мы значительно увеличивали концентрацию
ДНК; для их лучшего выявления изменяли условия фотосъемки и печати. В этих
условиях в верхней части геля выявлялись экстра-фрагменты, обычно повторяющие Х-
и Y-специфичные. Ниже уровня расположения специфических фрагментов выявлялись
мономорфные фрагменты. Нарушение соотношений праймер-матрица, как обычно,
вызывало образование димеров праймеров (локализующихся еще ниже). Артефактная
активность, в целом, была менее воспроизводима, чем специфическая активность, в
большей степени зависела от условий проведения исследования, индивидуальности
образцов. Малоинтенсивные экстра-фрагменты (обычно - три или четыре, не считая
димеров праймеров) выявлялись в нижней части геля. Интенсивность их была
различна и не находилась в прямой зависимости от «нагрузки» ДНК. По всей
видимости, амплификационный профиль артефактных фрагментов определяется
структурными, конформациоными особенностями ДНК.
Мы изучили картину, соответствующую увеличенному количеству циклов ПЦР, что
может быть актуальным при исследовании малых количеств ДНК. Дополнение обычных
30-35 циклов еще 10-15-ю циклами реамплификации (после повторного добавления
Taq-полимеразы), как и одномоментное проведение ПЦР в течение 45-50 циклов, к
появлению неспецифических фрагментов не приводило, что подтверждалось
исследованием контрольных проб. Например, проведение реамплификации в экспертизе
№ 5083 позволило повысить интенсивность Х-специфичного фрагмента в экспертной
пробе с малым количеством ДНК и уверенно его детектировать. Исследовались
микроследы крови, обнаруженной на раме разбитого окна, через которое
преступники, предположительно, покинули место происшествия. Экспертиза
проводилась нами в отсутствие подозреваемых, «по горячим следам». Обнаружение
крови женщины оказалось для розыска ценной поисковой информацией.
Не приводило к наработке неспецифических фрагментов и простое пролонгирование
амплификации до 45-50 циклов. Хотя, в силу снижения специфичности, такое
удлинение цикла при проведении ПЦР считается нежелательным, при исследовании
данного генетическим маркера мы появления экстра-фрагментов не наблюдали.
Артефактные фрагменты выявлялись при использовании реактивов неадекватного
качества, локализуясь в этом случае вблизи области Х- и Y-специфичных
фрагментов. Неадекватное качество реактивов сказывалось также на возможности
выявления специфических фрагментов. Как явно непригодная оценивалась
Taq-полимераза, которая, с одной стороны, продуцировала выраженные
экстра-фрагменты вблизи области специфических фрагментов, а с другой –
обеспечивала слабый специфический результат. Некоторые полимеразы
экстра-фрагментов не продуцировали, однако, несмотря на соблюдение оптимальных
условий ПЦР, были «склонны» к выраженной преимущественной амплификации.
3) Валидационные исследования
Разработанную методику применили для исследования более 100 различных
судебно-медицинских объектов с известной половой принадлежностью - следов крови,
спермы, вагинальных выделений, слюны, фрагментов органов, костей.
а) Исследование биологических объектов разного происхождения
При применении методики для исследования объектов указанного выше происхождения
результаты исследования во всех случаях получения генетического профиля
позволили правильно установить половую принадлежность объекта. Продукты
амплификации ДНК, выделенной из объектов разного происхождения, различий не
имели.
С образцами спермы со сниженным содержанием сперматозоидов (олигозооспермия)
также было возможно получение положительного результата.
б) Исследование образцов, содержащих смесь женской и мужской ДНК
Экспериментальные модели представляли собой: смесь спермы и вагинальных
выделений; кровь мужчины и женщины; смесь спермы, крови женщины и ее вагинальных
выделений; сперма двух мужчин и вагинальное содержимое. Всего было исследовано
48 «смешанных» следов. Эти модельные образцы использовались и в дальнейших
исследованиях.
В "смешанных" следах, как правило, выявлялся мужской профиль ДНК,
камуфлировавший женский. В отличие от продуктов амплификации "изолированных"
образцов мужской ДНК (мужской крови, спермы), в которых интенсивность Х- и
Y-специфичных фрагментов, как правило, была одинакова, либо в редких случаях, за
счет "преимущественной" амплификации, Х-специфичный фрагмент выявлялся несколько
слабее, двухфрагментный профиль ДНК "смешанных" следов часто характеризовался
более интенсивным Х-специфичным фрагментом, чем Y-специфичным. Это было
закономерным, так как отражало большее количество в пробе последовательностей
Х-хромосомы, чем Y-хромосомы. Этот признак выявлялся не всегда, что зависело в
каждом случае от количественного соотношения и степени деградации мужской и
женской ДНК. Однако, когда он обнаруживался, такая картина позволяла
предположить наличие смеси мужской и женской ДНК.
При исследовании нескольких образцов вагинальных выделений с примесью спермы (в
т.ч. взятых от лиц с олигозооспермией) обнаруживался лишь Х-специфичный
фрагмент. Подобное явление (отсутствие амплификационного сигнала одного из
компонентов смеси в силу малого количества ДНК или ее значительно
деградированного состояния) может встретиться и при исследовании любого
аутосомного локуса, поэтому его нельзя рассматривать как проблему, характерную
для амелогенинового теста.
Камуфлирование женского профиля мужским в “смешанных” следах является, на наш
взгляд, единственным отрицательным моментом диагностики пола с помощью анализа
ДНК, Подчеркнем, что этот феномен не связан с каким-либо определенным
генетическим маркером и свойственен исследованию любого ДНК-маркера пола. Его
необходимо учитывать при проведении экспертиз, поскольку в ряде случаев он может
создавать риск ошибочной интерпретации. Это не свидетельствует о том, что методы
ДНК-анализа не позволяют получить достоверные данные при определении пола, и
говорит только о том, что применение методов ДНК-анализа в судебно-медицинской
экспертизе имеет особенности; необходим также комплексный подход к исследованию.
Для правильной интерпретации данных экспертизы, помимо результатов анализа ДНК,
требуется принимать во внимание все данные в совокупности: обстоятельства дела,
локализацию пятна, характер и природу объекта, результаты ДНК-анализа
полиморфных локусов и других исследований. В частности, иногда может оказаться
полезным цитологическое исследование. Например, мы наблюдали довольно сложный
экспертный случай, когда в крови, которая, по имевшимся данным, произошла от
потерпевшей, неожиданно выявился «мужской» профиль ДНК. Как оказалось, причиной
этого была примесь к крови очень небольшого количества спермы, что было
установлено благодаря проведенному в дальнейшем цитологическому исследованию
(заранее оно в данном случае не планировалось).
Феномен, характерный для амелогенинового теста в случае «смешанного» характера
объекта, был совершенно аналогичным и при исследовании другого сегмента
амелогенинового гена, описанного в дальнейшем Manucci А. и соавт. [31].
в) Исследование следов разной давности образования
В этой серии опытов были использованы образцы с различной давностью образования.
Наблюдения показали, что эффективность исследования определяется не столько
давностью образования следов, сколько состоянием в них ДНК, которое не находится
в прямой зависимости от срока хранения объекта, завися от целого ряда факторов.
Для получения положительного результата исследования со старыми образцами
требовалось использование больших количеств материала, чем со свежими следами. В
ряде образцов амплификации препятствовала деградация.
г) Исследование следов, расположенных на различных предметах-носителях
Из опыта использования в экспертизах серологических методов мы знали, что
наибольшие проблемы со стороны предмета-носителя возникают при расположении
следов на джинсовой ткани. Поэтому, приступая к изучению ПЦР, мы, прежде всего,
обратили внимание на эту ткань. Каковы возможности ПЦР в отношении исследования
таких объектов? Уже первые исследования показали нам, что джинсовая ткань влияет
и на ПЦР, вызывая в ряде случаев ее ингибирование. Разная джинсовая ткань
оказывала неодинаковое влияние на результаты ПЦР: ингибирующий эффект темных
тканей был больше, чем светлых. Это получило подтверждение в экспертизах. Так,
например, нам удалось успешно, без применения каких-либо дополнительных
процедур, провести амплификацию сегмента амелогенинового гена в экспертизах №№
1126, 1127 при локализации следов на светло-голубой джинсовой ткани. В то же
время, в другой экспертизе при исследовании черной джинсовой ткани получить
генетический профиль не удалось ни в одном из трех исследовавшихся объектов.
Большее ингибирующее влияние темных джинсовых тканей, по сравнению со светлыми,
было впоследствии отмечено в литературе в отношении других генетических маркеров
[32]. Ингибирующий эффект в ряде случаев отмечался нами также со стороны
некоторых других тканей, что, видимо, также было связано с воздействием тех или
иных красителей. На этапе выделения ДНК индикатором возможного последующего
ингибирования ПЦР являлась окрашенная водная фаза, не обесцвечиваемая, несмотря
на неоднократную обработку пробы фенолом и хлороформом.
На наш взгляд, эффективность исследования таких объектов можно значительно
повысить, разработав методы, позволяющие специфически воздействовать на
ингибирующие субстанции. Для этого требуется изучение биохимической основы
ингибирования ПЦР со стороны веществ, содержащихся в носителях. Реализация этого
подхода позволит решать проблему преодоления ингибирования ПЦР
дифференцированно, дополнив универсальные методы специфическими для той или иной
группы предметов-носителей.
д) Исследование образцов с микробным загрязнением
Микробное загрязнение судебно-медицинских объектов является фактором,
существенно осложняющим идентификацию изосерологических генетических маркеров, и
в ряде случаев ведет к ошибочному определению групповой принадлежности в
экспертизах. Изучая ранее этот вопрос применительно к системе АВО, мы продолжили
данные исследования в отношении ДНК-маркеров. В опыты включали, в том числе, те
образцы, которые в свое время создавали для нас проблемы в экспертизах. В
частности, мы использовали загрязненные предметы-носители, оставшиеся после
проведения традиционных экспертиз вещественных доказательств. Учитывая, что
источником микробного загрязнения может служит микрофлора, присутствующая в
биологическом субстрате уже in vivo, мы включили в исследование образцы
выделений, взятых от лиц с урогенитальными заболеваниями воспалительного
характера. По нашим наблюдениям, в ПЦР присутствие микрофлоры к неспецифическим
явлениям не вело. В то же время, у нас сложилось впечатление, что для
типирования таких образцов несколько более актуальна проблема деградации ДНК.
В ходе этих исследований была также разработана модель судебно-медицинской
диагностики пола, которая осталась актуальной и для исследования других
маркеров.
Помимо амелогенинового гена, в ограниченном объеме изучали некоторые другие
маркеры, например, Y-специфичный сегмент сателлита III (Fowler C., 1987).
Экспертное применение маркера, описанного Witt M. и Erickson R.P. [33], для
исследования которого необходимы разные пары праймеров для амплификации участков
Х- и Y-хромосом, свидетельствовало о достаточно высокой эффективности метода в
отношении деградированной ДНК. Например, в экспертизе № 1161, при положительном
результате исследования объекта (пятна крови) по данному маркеру, при
типировании с помощью тест-системы “POLYMARKER” положительный результат был
получен только по одному локусу - Gc; с амелогениновым маркером 977/788 п.н.о.
был получен отрицательный результат. Однако, как и при исследовании других
маркеров, при которых сегменты Х- и Y-хромосомы амплифицируются в разных
реакциях, недостаток этого маркера был в том, что Х- и Y-специфичные сигналы не
регистрировались в едином профиле ДНК и, в силу этого, мог наблюдаться их
дисбаланс. С тем, чтобы это не отразилось на интерпретации результатов,
тест-система оптимизировалась с преимуществом в пользу амплификации
Y-специфичного фрагмента.
Несмотря на достаточно хорошую разработанность методов диагностики пола,
изыскание новых участков, проявляющих Х-Y-специфичность, не утратило
актуальности, поскольку каждый из известных сейчас маркеров не лишен того или
иного недостатка. Так, амелогениновый маркер с фрагментами 977/788 п.н.о.
исключительно удобен для исследования, поскольку значительная разница в длине
амплифицируемых фрагментов делает пригодным наиболее простой вариант
электрофореза - в агарозном геле. В то же время, чувствительность данной системы
из-за довольно крупных фрагментов недостаточно высока. Исследование участка
амелогенина с фрагментами 106/112 п.н.о. обладает высокой чувствительностью,
однако, в силу малой разницы в длине Х- и Y-специфичных фрагментов, оно требует
использования ПААГ. Кроме того, как было отмечено в обзоре литературы, описана
мутация в данном участке, явившаяся причиной искажения результата определения
пола [34].
Наши последние исследования связаны с изучением целой серии новых
генетических маркеров различной локализации, обнаруженных недавно Рогаевым Е.И.
и Григоренко А.П.: AEM-1 (размеры ПЦР-продуктов (Х/Y): 139/118 п.н.о.), FEM-2
(185/167 п.н.о.), FEM-3 (286/316 п.н.о.), FEM-4 (292/254 п.н.о.), FEM-5 (650/350
п.н.о.). Ими были выведены последовательности праймеров и выполнена
ПЦР-амплификация данных регионов. Как и в случае амелогениновых маркеров,
исследование этих участков также основано на одномоментной амплификации Х- и
Y-специфичных последовательностей, с детекцией их в едином генетическом профиле.
Мы изучали данные участки применительно к исследованию судебно-медицинских
объектов.
Для ПЦР использовали буфер, содержащий 67 mM трис-HCl, pH 8,8; 16,6 mM
сульфата аммония; 0,01% Tween 20; 0,1 М 2-меркаптоэтанола. Концентрация MgCl2
составляла 1,5-2 mM. Taq-полимеразу добавляли из расчета 1 ед. на 25 мкл
реакционной смеси. Циклы амплификации: 94оС - 4 мин (начальная денатурация);
94оС - 1 мин, 58оС - 1 мин, 72оС - 1 мин (30 циклов); 72оС - 5 мин (конечная
ренатурация). Электрофорез в 3%-м агарозном геле в течение 1 ч, окрашивание
этидия бромидом.
Для проведения экспериментов использовали ту же методическую стратегию,
которая была разработана нами ранее для амелогенинового маркера. Проверку
специфичности для каждой из пар праймеров осуществляли, исследуя ДНК
индивидуумов известного пола. Во всех случаях был получен соответствующий
генетический профиль: сочетание двух фрагментов указанных выше размеров при
исследовании мужской ДНК и единичный Х-специфичный фрагмент при исследовании
женской ДНК. Каждый из маркеров исследован на панели из образцов жидкой крови,
пятен крови и спермы, нанесенных на марлю и другие предметы-носители,
“смешанных” следов (содержащих ДНК мужчины и женщины). Присутствие микрофлоры в
исследованных нами экспериментальных образцах на характер выявленных
генетических профилей влияния не оказывало. Олигозооспермия, характерная для
ряда исследованных образцов (в нашем экспериментальном материале - достигающая
5-кратного снижения содержания сперматозоидов по сравнению с границей нормы), не
препятствовала типированию. Исследование пятен, содержащих смесь мужской и
женской ДНК, показало ту же картину, что и при исследовании амелогенинового
маркера (зависящую от соотношения и способности к амплификации компонентов
смеси): как правило, камуфлирование “женского” профиля “мужским”, с
преобладанием в ряде случаев Х-специфичного сигнала, либо (реже) выявление
“женского” профиля.
Данные маркеры, в силу небольших размеров амплифицируемых участков,
перспективны для исследования деградированной ДНК. При этом, значительная
разница в длине фрагментов дает возможность применять электрофорез в агарозном
геле. Таким образом, они сочетают достоинства обоих амелогениновых маркеров.
Возможность использования для их исследования обычного агарозного геля создает
предпосылки для применения этих методов в качестве экспресс-тестов для скрининга
в случае, когда на экспертизу поступают объекты, целесообразность дальнейшего
исследования которых целиком определяется их половой принадлежностью. Это очень
удобно для практики. Мы продолжаем изучение данных маркеров.
Введение в экспертизу методов диагностики пола на основе ДНК-маркеров
поставило вопрос о сравнительной оценке этих методов с традиционным,
цитологическим методом установления половой принадлежности. С этой целью нами
был проведен анализ преимуществ и недостатков методов исследования ДНК по
сравнению с цитологическим методом.
К преимуществам ДНК-анализа применительно к установлению половой
принадлежности можно отнести следующие:
- Положительный результат цитологического исследования возможен только при
условии относительно хорошего состояния объекта, сохранности клеточной
структуры. Для достоверного вывода требуется значительное число неизмененных
клеток в препарате, что обусловливает необходимость довольно большого
количества материала. Требования к состоянию объекта и количеству материала
при ДНК-анализе меньше.
- При ДНК-анализе интерпретация результатов проста и объективна. Учет
результатов цитологического исследования трудоемок, субъективен, правильность
оценки данных во многом зависит от квалификации эксперта.
- Результаты ДНК-анализа легко документируются, что позволяет сохранить
первичные материалы и представить их в суд. Результаты цитологического
исследования документировать сложно, поэтому после его проведения, как
правило, остаются только записи в рабочем журнале.
- При выполнении экспертизы с использованием ДНК-анализа установление пола
по ДНК целесообразно и в методическом отношении:
а) этот метод имеет ту же пробоподготовку, что и методы исследования
полиморфных локусов. Поэтому в случае, когда объект исследуется (или
планируется его исследование) по полиморфным локусам, проводить определение
пола также по ДНК и технически удобно, целесообразно с точки экономного
использования экспертного материала;
б) маркер пола может исследоваться в едином комплексе с STR-локусами, причем
такое исследование возможно в течение одной ПЦР. Это позволяет непосредственно
сопоставлять результаты исследования пола и полиморфных локусов, что особенно
важно при исследовании "смешанных" следов.
- Особые преимущества ДНК-анализ имеет при определении женского пола,
поскольку позволяет непосредственно выявить маркерный участок Х-хромосомы; его
обнаружение, при отсутствии фрагмента Y-хромосомы, достоверно и однозначно
свидетельствует о присутствии в объекте ДНК женщины. При использовании
цитологического метода вывод о половой принадлежности объекта в случае
женского пола делается лишь на основании статистической оценки данных
выявления определенных клеточных структур с заданной степенью надежности.
Несмотря на отмеченные преимущества ДНК-анализа, у цитологического
исследования есть также свои сильные стороны:
- При ДНК-анализе генетический профиль выявляется безотносительно к
источнику его происхождения. В отличие от этого, цитологический метод
позволяет устанавливать природу носителя маркера пола, что является важным в
случае "смешанных" следов. Например, он дает возможность отнести его выявление
непосредственно за счет крови, буккального эпителия и т.д. Ценным для
интерпретации результата при исследовании таких объектов может оказаться
выявление при цитологическом исследовании в пятне сперматозоидов или других
клеточных структур.
- При ДНК-анализе маркер Х-хромосомы одинаков и для мужской, и для женской
ДНК. Поэтому «смешанный» характер следов может быть неочевиден и генетический
профиль будет интерпретироваться только как «мужской». В отличие от этого,
признаки, выявляемые при цитологическом исследовании, позволяют установить
присутствие в пятне структуры, характерной именно для женского генетического
пола, а не просто для Х-хромосомы. В связи с этим, в случае, когда не
исключается "смешанный" характер следов, использование цитологического метода
может оказаться полезным для уточнения результата.
- Свойства экспертных объектов многообразны, что не обеспечивает
"универсальной" результативности метода, даже сколь угодно эффективного.
Цитологическое исследование может быть целесообразно, например, при
ингибировании ПЦР.
Все это позволяет сделать вывод о том, что хотя в целом ДНК-анализ имеет
преимущества перед цитологическим методом установления пола, он его не
«отменяет»; цитологический метод должен оставаться в экспертном комплексе.
В заключение этого раздела работы отметим, что методика определения пола с
помощью ДНК-анализа может иметь и несколько иное применение в экспертизе. В
литературе нам не встретилось указания на возможность использования этого теста
для определения наличия мужской ДНК в потенциально "смешанных" пятнах с целью
получения оснований для проведения дальнейшего идентификационного анализа, и
хотелось бы ее отметить. Так, если при исследовании вагинального содержимого
обнаруживается мужской профиль, это служит свидетельством того, что имелся
половой контакт и в следах содержится генетический материал мужчины. В подобных
случаях ДНК-анализ может в определенной степени выполнить задачи, решаемые
методом установления наличия спермы (разумеется, доказательством наличия в пятне
спермы как таковой он, строго говоря, не является). Такое исследование может
иметь значение для идентификации в случаях:
а) если из-за нарушения состава спермы в ее следах не обнаруживаются
сперматозоиды, однако, имеются незрелые формы спермальных клеточных элементов и
эпителиальные клетки;
б) при половом контакте, не закончившемся эякуляцией, когда сперматозоиды в
вагинальном содержимом отсутствуют, но могут иметься эпителиальные клетки
мужского урогенитального тракта;
в) при разрушении в пятне клеточных мембран сперматозоидов, вследствие чего
сперматозоиды не детектируются, однако оставшийся генетический материал может
позволить выявить присутствие мужской ДНК.
Поскольку для установления наличия спермы на практике, как правило,
используется только цитологический метод, при необнаружении сперматозоидов
объект далее не исследуется. ДНК-анализ может расширить круг объектов
идентификации. Проводить исследование ДНК на пол (при отрицательном результате
цитологического метода) может быть целесообразно, например, при выявлении у
подозреваемого олиго- или азооспермии.
Исследование VNTR-локусов
Параллельно с изучением амелогенинового маркера нами проводились также
эксперименты по исследованию VNTR-локусов. Результаты проведенных исследований
легли в основу методических рекомендаций "Исследование объектов
судебно-биологической экспертизы полимеразной цепной реакцией", изданных МВД РФ
[15], подготовленные в 1994 году и уже с этого времени использовавшиеся в
экспертной практике.
Оптимизация параметров исследования
Схема экспериментов по оптимизации условий проведения исследования была
аналогичной той, которая использовалась для амелогенина. Использовались
несколько вариантов последовательностей праймеров для амплификации одного и того
же маркера. Параметры исследования приведены в [15].
Специфичность результатов исследования
Специфичность реакции зависела от условий проведения ПЦР – концентрации
реагентов и их качества, заданных параметров циклов амплификации и точности их
воспроизведения.
(а) Артефакты. Увеличение числа циклов амплификации до 45 и более в ряде случаев
приводило к появлению фоновых артефактных фрагментов, которые в наших опытах
наблюдались, в основном, в локусе АроВ. Природу их можно объяснить следующим
образом. Локус АроВ имеет высокое содержание АТ-оснований, что может служить
причиной ошибки Taq-полимеразы [23]. Фоновые фрагменты являются, главным
образом, неполными одноцепочечными матрицами, оставшимися после предыдущих
циклов, которые могут выступать в роли праймеров при отжиге в более поздних
циклах. Из-за комплементарности тандемных повторов друг другу, они могут
гибридизоваться в нескольких сайтах данного региона, неспецифически отжигаясь.
Это приводит к образованию ПЦР-продуктов аномальной длины, которые могут
визуализоваться в окрашенном этидием бромидом агарозном геле после достаточного
числа циклов. Ошибки Taq-полимеразы представляют собой, главным образом, замену
основания и смещения на одно основание [35].
В локусе D1S80, даже при соблюдении стандартных условий ПЦР, в области
аллельного диапазона в ряде случаев исследования гетерозиготных образцов
выявлялся минорный гетеродуплексный экстра-фрагмент. Это наблюдалось только при
проведении электрофореза в агарозном геле, не выявляясь при использовании ПААГ.
Этот момент, а также лучшее разрешение, достигаемое использованием ПААГ, делало
при исследовании этого локуса проведение электрофореза в ПААГ предпочтительным.
(б) Преимущественная амплификация. В VNTR-локусах в ряде случаев была отмечена
преимущественная амплификация. Если в локусах АроВ и D1S80 она встречалась в
виде неодинаковой интенсивности аллельных фрагментов в некоторых гетерозиготных
образцах, то в локусе D17S30 было отмечено также “выпадение” аллеля. Хотя
преимущественную амплификацию связывают, в основном, с деградацией ДНК, в силу
которой амплификация фрагментов разной длины может иметь разную эффективность, у
нас имелось наблюдение о “выпадении” аллеля в образце, состояние ДНК которого не
давало основания для отнесения этого факта за счет деградации (а также для
объяснения его стохастическим эффектом, поскольку количество ДНК было
достаточным). Заслуживает внимания, что "выпадение” аллеля в этом образце не
отличалось воспроизводимостью: в некоторых опытах, без изменения каких-либо
параметров, регистрировалось гетерозиготное состояние.
Причины выраженной преимущественной амплификации в локусе D17S30 обсуждаются в
литературе. В качестве возможной причины называется GC-состав. Отмечено, что
высокое содержание GC-оснований может обусловить неполную денатурацию матрицы и
оказать этим воздействие на амплификацию аллелей (Budowle В. et al., 1994).
Поскольку в локусе D17S30 имеется 65%-е содержание GC-оснований, этот механизм
для данного локуса, видимо, актуален.
Проведенная нами оптимизация условий ПЦР с целью поиска путей для преодоления
преимущественной амплификации в локусе D17S30 показала, что для стабильного
устранения несбалансированной амплификации в “проблемном” образце может
потребоваться использование не вполне оптимальных условий исследования других
образцов, что, таким образом, не решает проблемы в целом. В связи с этим, мы
рекомендовали экспертам быть весьма осторожными при исследовании этого локуса,
отказываясь от дачи по нему заключения во всех случаях, когда возможность
преимущественной амплификации могла изменить интерпретацию. Наиболее серьезные
проблемы могли возникнуть при исследовании “смешанных” следов, особенно в
случаях групповых преступлений, когда интерпретация особенно сложна. В этом
смысле небезосновательным был вывод Ivey и соавт., которые, испытав для
преодоления преимущественной амплификации в локусе D17S30 различные способы,
пришли к заключению, что, независимо от причин аллельного «выпадения», этот
локус на данном этапе лучше не использовать в практической работе ни при
установлении отцовства, ни при исследовании вещественных доказательств [36].
Учитывая, что при внимательном отношении к исследованию ошибок можно избежать, а
также сравнительно небольшой спектр ПЦР-маркеров, которые в тот период времени
можно было реально исследовать в экспертизе, мы нашли этот вывод слишком
категоричным. В дальнейшем же, когда появилась возможность проведения
STR-анализа, исследование этого весьма сложного для интерпретации генетического
маркера утратило целесообразнность.
Если на начальных этапах исследований мы получали праймеры и другие составляющие
реакционной смеси из разных источников, то в 1993-1994 годах появились готовые
наборы реагентов для ПЦР. Пригодными для наших целей оказывались не все
получаемые наборы, причем различались по качеству как реагенты, изготовленные
разными фирмами, так и наборы разных партий одной и той же фирмы. Реагенты
проверяли на судебно-медицинских образцах - пятнах крови, выделений.
Сопоставимость результатов, получаемых при использовании реагентов разных
изготовителей было предметом нашего особого внимания в этот период, поскольку
стандартные, сертифицированные наборы на отечественном рынке реагентов
отсутствовали.
Валидационные исследования
Валидационные эксперименты, проведенные с учетом особенностей
судебно-медицинских объектов, показали пригодность этих тестов для
судебно-медицинских исследований. При этом были отмечены следующие моменты.
- При исследовании ДНК, выделенной из объектов разного происхождения,
полученные генетические профили были идентичны. Присутствие микрофлоры
(устанавливаемое цитологически) к искажению аллельной харатеристики не
приводило. Важным фактором являлся предмет-носитель, который достаточно часто
влиял на возможность получения профиля (но не на его характер в случае
положительного результата). Например, при исследовании экспериментальных
следов спермы, нанесенной на реальные предметы-носители, оставшиеся у нас
после проведения одной из серологических экспертиз (№ 177), не была типирована
ДНК, выделенная из следов, нанесенных на трикотажную и синтетическую цветные
ткани (юбка и зонт потерпевшей). При этом, причина отрицательного результата
заключалась именно в ингибирующем влиянии предмета-носителя, поскольку
выделенная ДНК была в хорошем состоянии и количество ее было достаточном для
типирования; соответствующий образец, нанесенный на марлю, типировался.
- При исследовании образцов с олигозооспермией изначально сниженное
количество сперматозоидов (в наших образцах – до пятикратного по сравнению с
нижней границей нормы) типированию не препятствовало.
Проблема преобразования информации при ДНК-анализе представляет большой
интерес. Выяснение возможностей получения неверных генетических характеристик
являлось важным моментом экспериментальной части нашего исследования. Мы также
провели сравнительный анализ подобных ситуаций применительно к ДНК-анализу и
традиционному, иммунологическиму исследованию.
Для получения достоверных результатов использования ПЦР (как и применения
иммунологических методов) необходимо соблюдение адекватных условий проведения
исследования. Это включает в себя целый комплекс требований, касающихся
оптимальных параметров реакции, качества реактивов и оборудования и др. При
нарушении этих условий при исследовании ДНК могут быть получены неверные данные,
вариантами которых являются следующие: (1) ложноположительные результаты: (а)
появление, кроме истинных аллельных фрагментов, также экстра-фрагментов, (б)
выявление неспецифических фрагментов при отсутствии истинных аллельных
фрагментов; (2) отрицательный результат – отсутствие ПЦР-продукта; (в)
ложноотрицательный результат - «выпадение» одного из аллелей гетерозиготного
профиля. Достоверность результатов, как и в случае иммунологических методов,
должно контролироваться применением специальных тестов.
Особый интерес представляет вопрос о том, возможно ли искажение данных при
отсутствии нарушений условий проведения исследования - за счет характера самого
объекта. При применении иммунологических методов присутствие микрофлоры или
влияние предмета-носителя могут быть причиной ложноположительного результата и
создать риск неправильного определения групповой принадлежности. При
исследовании VNTR-локусов мы не наблюдали ложноположительных результатов за счет
указанных факторов (в данном случае это означало бы появление экстра-фрагментов).
Влияние этих факторов могло заключаться в ингибировании ПЦР и деградации ДНК,
что могло служить причиной отрицательного результата типирования (отсутствия
генетического профиля).
«Отрицательный» результат означает не вполне то же, что «ложноотрицательный»,
с которым можно столкнуться при применении иммунологических методов, где он
может вести к неправильной интерпретации (например, невыявление антигена А в
следах группы А – к диагностике группы О, антигена А в группе АВ – к диагностике
группы В и т.д.). Отсутствие генетического профиля не создает риска неправильной
интерпретации. Однако как «ложноотрицательный» результат при ПЦР можно
расценивать искажение профиля ДНК при преимущественной амплификации, в случае ее
крайнего выражения - «выпадения» аллеля. Это необходимо учитывать при оценке
результатов исследования ДНК с выраженной деградацией, ее малых количеств
(возможность стохастического эффекта); актуальным это может быть, главным
образом, при исследовании локусов с существенной разницей в длине
последовательностей аллельных вариантов. В наших экспериментах мы реально
столкнулись с «выпадением» аллеля только при исследовании локуса D17S30.
Наряду с отмеченными положительными моментами использования VNTR-анализа,
следует отметить следующее. Образцы, в которых, в силу выраженной деградации или
ингибирующего влияния на ПЦР предмета-носителя, ДНК не была типирована по
VNTR-локусам, были успешно исследованы реакцией абсорбции-элюции (в ряде случаев
были использованы специальные методические подходы для предотвращения
неспецифических явлений). В качестве экспертного примера можно привести
экспертизу № 9530. Исследуя следы крови на подушке и покрывале из цветного
плюша, изъятых в квартире лица, подозреваемого в совершении убийства, мы
получили отрицательный результат амплификации по локусам АроВ и D17S30. Те же
объекты, однако, были успешно исследованы нами по системам АВО и MNSs, что
позволило, тем самым, решить крайне важный для следствия вопрос о возможности
происхождения крови от проходящих по делу лиц.
Использование современных систем очистки и анализа ДНК существенно повысило
чувствительность методов исследования ДНК, сделав проблему «нетипируемых»
образцов значительно менее актуальной. В то же время, такие образцы все же
остаются в практике эксперта, и не исключено, что в этом случае иммунологические
методы могут оказаться полезны. Таким образом, оценивая методы ДНК-анализа как
значительно превосходящие по информативности иммунологические методы, последние,
тем не менее, не следует сбрасывать со счетов.
Таким образом, результаты исследования амелогенинового маркера и VNTR-локусов
показали пригодность ПЦР для судебно-медицинских целей: типирование было
осуществимо в отношении ДНК, выделенной из образцов разного происхождения;
получаемые при этом генетические профили были идентичны, результаты
воспроизводимы; требуемые для ПЦР количество и качество ДНК адекватны реалиям
судебно-медицинской экспертизы; присутствие микрофлоры не искажало генетические
профили, так, чтобы это могло стать причиной ошибочного результата типирования.
Полученные данные явились основанием начать в 1992 году использование ПЦР в
экспертизах вещественных доказательств. Внедрение этих методов исследования
позволило уже в 1993 году полностью заменить в практике ЭКЦ МВД РФ ПДРФ-анализ
полимеразной цепной реакцией; ПЦР стала применяться для проведения всех основных
видов идентификационных исследований биологических объектов [37]. В 1992-1994
годах в Экспертно-криминалистическом центре с использованием ПЦР было выполнено
78 экспертиз вещественных доказательств, к 1996 году – около 300 [38]. Введению
этой реакции в экспертную практику способствовало появление готовых наборов
реагентов для ПЦР, которые к этому времени стали выпускать отечественные
молекулярно-генетические лаборатории ("ГНИИ генетики" и др.), а также
опубликованных популяционных данных [39,40].
Выбор ПЦР в качестве базисной технологии экспертных методик имел важное
значение для внедрение ДНК-анализа в практику экспертной службы в целом. В
отличие от ПДРФ-анализа, не только обладавшего значительно меньшей
эффективностью, но и более сложного в техническом отношении, а также
требовавшего обеспечения радиационной безопасности, ПЦР оказалась доступной для
применения в региональных экспертных лабораториях. Таким образом, уже в
1993-1994 годах (рано по меркам не только отечественной, но и мировой судебной
медицины) Экспертно-криминалистический центр оказался готов к введению методов
анализа ДНК в практику региональных экспертных подразделений. Применению ПЦР был
посвящен Всероссийский семинар экспертов-биологов органов внутренних дел РФ в г.
Барнауле (1993). В 1994 году в службе имелось 8, в 1996 году - 14 лабораторий
ДНК-анализа, созданных в различных регионах России; для всех этих лабораторий в
1993-1996 годах нами были подготовлены специалисты. Об экспертной работе одной
из таких лабораторий (ЭКУ УВД Алтайского края) сообщается в публикации
начальника ЭКУ УВД Алтайского края [41]. В 1994-1995 годах с применением ПЦР в
этой лаборатории было выполнено уже 66 идентификационных экспертиз.
Исследование локуса HLA-DQА1
Оптимизация условий проведения исследования
В связи с тем, что эта тест-система хорошо отработана изготовителем и
стандартна, выбор параметров исследования не требуется. Тем не менее, для
получения четкого и хорошо читаемого результата необходимо соблюдение некоторых
технических деталей, что не нашло достаточного отражения в руководстве
изготовителя.
Наиболее существенным является строгое соблюдение условий, обеспечивающих
полную денатурацию ДНК перед гибридизацией с аллель-специфичными зондами. Если
после инкубации при 950С амплификат даже очень непродолжительное время находился
при комнатной температуре, то ДНК быстро ренатурирует и получаемый результат
оказывается слабым. Во избежание этого: (а) термостаты, в которых проводились
денатурация (950С) и гибридизация (550С), должны находиться рядом; (б) пробирки
с денатурированной ДНК доставать не все сразу, а по мере внесения проб в
гибридизационную смесь; (в) температура ее в кювете заранее должна быть доведена
до заданной. Необходимо также на этапе подготовки к гибридизации предотвращать
выпадение SDS в гибридизационной смеси. Для этого важно не только прогревать
исходный матричный раствор, но и не допускать остывания гибридизационной смеси
на последующих этапах. С этой целью все используемые при постановке гибридизации
емкости предварительно прогревать, внесение в кювету гибридизационной смеси и
амплифицированной ДНК производить непосредственно в термостате. Отмывание
фильтров после гибридизации удобнее и быстрее выполнять не путем отсасывания
раствора, как рекомендовано в инструкции, а посредством переноса фильтров при
каждом отмывании в свежий раствор, используя необходимое количество кювет.
2. Экспертная апробация
Результаты исследования локуса HLA-DQА1 в судебно-медицинских экспертизах
показали высокую эффективность используемой тест-системы. Выполняемые с ее
помощью исследования отличались высокой чувствительностью в отношении
судебно-медицинских объектов. При исследовании локуса HLA-DQА1 не актуальна
проблема преимущественной амплификации. Большим достоинством тест-системы
является стандартность реагентов. Кроме того, в техническом отношении
исследование не трудоемко и быстро осуществимо.
Не обладая, однако, высоким полиморфизмом, локус HLA-DQА1, сам по себе, не
обеспечивал в экспертизах низких значений вероятностей случайного совпадения.
Тем не менее, его дифференцирующая способность очень высока, что, в совокупности
с оперативностью получения результатов, делало его крайне удобным для скрининга,
если по делу проходило более чем одно лицо.
Таблица 1
Дифференцирующая способность тест-системы для типирования локуса HLA-DQА1
(экспертиза с большим числом проходящих по делу лиц)
|
Объекты |
Зонды к аллелям |
Выявленный аллельный профиль |
|
1 |
2 |
3 |
4 |
Всем |
1.1 |
1.2
1.3
4 |
1.3 |
Всем,
кроме 1.3 |
|
Пятно на простыне |
- |
- |
+ |
+ |
+ |
- |
+ |
- |
+ |
3, 4 |
|
Подозреваемый 1 |
- |
- |
+ |
+ |
+ |
- |
+ |
- |
+ |
3, 4 |
|
Подозреваемый 2 |
+ |
- |
- |
+ |
+ |
+ |
+ |
- |
+ |
1.1, 4 |
|
Подозреваемый 3 |
- |
+ |
- |
+ |
+ |
- |
+ |
- |
+ |
2, 4 |
|
Подозреваемый 4 |
+ |
- |
+ |
- |
+ |
- |
+ |
- |
+ |
1.2, 3 |
|
Подозреваемый 5 |
+ |
- |
- |
- |
+ |
+ |
+ |
- |
+ |
1.1, 1.2 |
|
Подозреваемый 6 |
- |
+ |
- |
+ |
+ |
- |
+ |
- |
+ |
2, 4 |
|
Подозреваемый 7 |
+ |
- |
- |
- |
+ |
+ |
+ |
- |
+ |
1.1, 1.2 |
|
Положительный контроль |
+ |
- |
- |
+ |
+ |
+ |
+ |
- |
+ |
1.1, 4 |
|
Отрицательный контроль |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
Примечание. Аллельный профиль потерпевшей не определился в связи с сильной
деградацией ДНК ее крови. В данном случае это интерпретации не препятствовало,
учитывая сочетание выявленных генотипов, а также результаты цитологического и
микроспектрального исследований (большое количество сперматозоидов без примеси
эпителиальных клеток с Х-хроматином, отрицательный результат исследования на
наличие крови).
Таблица 2
Результаты типирования локуса HLA-DQА1 в экспертизе по делу о детоубийстве
|
Объекты исследования |
Зонды к аллелям |
Выявленный генотип |
|
1 |
2 |
3 |
4 |
Все |
1.1 |
1.2
1.3
4 |
1.3 |
Всем,
кроме 1.3 |
|
Кровь из трупа младенца |
- |
+ |
- |
+ |
+ |
- |
+ |
- |
+ |
2, 4 |
|
Кровь подозреваемой К. |
+ |
- |
- |
+ |
+ |
- |
+ |
- |
+ |
1.2, 4 |
Таблица 3
Результаты типирования локуса HLA-DQА1 в экспертизе по делу об изнасиловании
несовершеннолетней
|
Объекты исследования |
Зонды к аллелям |
Выявленный генотип |
|
1 |
2 |
3 |
4 |
Все |
1.1 |
1.2
1.3
4 |
1.3 |
Всем,
кроме 1.3 |
|
Кровь подозреваемого Н. |
- |
+ |
- |
+ |
+ |
- |
+ |
- |
+ |
2, 4 |
|
Кровь потерпевшей Б. |
- |
- |
+ |
+ |
+ |
- |
+ |
- |
+ |
3, 4 |
|
Ткани плода |
- |
- |
- |
+ |
+ |
- |
+ |
- |
+ |
4, 4 |
Это демонстрируют приведенная ниже экспертиза, назначенная по факту
изнасилования несовершеннолетней М. (Заключения эксперта №№ 2237, 2306). На
исследование была представлена простыня, изъятая с места происшествия. По
уголовному делу в качестве подозреваемых проходило 7 мужчин. В следах на
представленной на исследование простыне была обнаружена сперма, результаты
исследования которой по системам АВО и "выделительства" не исключили возможность
ее происхождения ни от одного из 7 проходящих по делу лиц. При исследовании
локуса HLA-DQА1 выявленный аллельный профиль (3,4) имел достаточно высокую
частоту встречаемости – 0,11. Тем не менее, его обнаружение позволило сразу
исключить 6-х подозреваемых и вести дальнейшую идентификацию в отношении лишь
одного лица (табл. 1).
Еще более высокие цифры вероятностей получались в экспертизах родства. Так, в
экспертизе, проведенной по факту обнаружения трупа младенца (Заключение эксперта
№ 2734 от 12.08.93 г.) вероятность случайного совпадения признаков, выявленных в
генотипах младенца и подозреваемой К., составила 0,47 (табл. 2).
Такая же вероятность (0,47) была получена и в экспертизе, проведенной по
факту изнасилования несовершеннолетней Б. (Заключение эксперта № 991 от 09.93
г.), в результате которого произошло зачатие. Исследованию подвергали ткани
абортированного плода (табл. 3).
Тем не менее, высокая чувствительность системы, надежность результатов,
обеспечиваемая высоким качеством и стандартностью реактивов, возможность
оперативного получения данных позволили оценить локус HLA-DQА1 как
высокоэффективный для судебно-медицинского исследования.
Исследование локусов LDLR, GYPA, HBGG, D7S8 и GC («POLYMARKER»)
Техника исследования этих локусов не имеет особенностей по сравнению с
исследованием локуса HLA-DQА1.
Экспертное применение системы «POLYMARKER» имело достаточно высокую
эффективность, позволяя получать генетические профили в условиях весьма
выраженной деградации ДНК. При типировании деградированной ДНК в отдельных
случаях проявлялась неодинаковая способность к амплификации по разным локусам
этого комплекса.
Примером могут служить результаты экспертизы, назначенной по факту убийства
гр-ки С. (Заключение эксперта № 1161). По уголовному делу в качестве
подозреваемого проходил гр-н К., у которого был изъят пиджак со следами бурого
цвета, в которых была обнаружена кровь. При проведенных ранее двух экспертизах
были получены противоречивые данные в отношении возможности происхождения этих
следов от потерпевшей С. В связи с этим, была назначена данная экспертиза. Нами
было выполнено исследование остатков двух следов крови на пиджаке после
проведения предыдущих экспертиз, а также трех пятен, не исследованных ранее, в
одном из которых была обнаружена кровь человека. При типировании ДНК, выделенной
из следов, содержаших кровь, по локусам «POLYMARKER» и маркеру пола, было
установлено, что кровь во всех трех следах могла произойти от самого гр-на К.;
происхождение ее от потерпевшей С. исключалось. ДНК, выделенная из одного из
следов, протипировалась только по локусу Gc, имеющему в комлексе «POLYMARKER»
наиболее короткие амплификационные аллельные фрагменты. Результаты исследования
в этой экспертизе маркера пола обсуждались выше.
Уже к середине 90-х годов в практике Экспертно-криминалистического центра на
основе ПЦР исследовался широкий спектр генетических маркеров – маркеры пола,
VNTR-локусы, локусы HLA-DQА1 и «POLYMARKER», отдельные STR-локусы. Совместное
исследование этих маркеров значительно повысило возможности экспертиз
вещественных доказательств. Впервые в практике МВД нами с помощью ПЦР было
проведено идентификационное исследование костных останков неопознанного лица
(Заключение эксперта № 1665 от 10.07.95 г.), сожженный скелетированный труп
которого был обнаружен в сожженной автомашине. С использованием специальных
методических подходов четкие генетические профили удалось получить по всем 10-ти
исследованным полиморфным локусам, а также по амелогениновому маркеру. В
дальнейшем мы провели подробный анализ этого случая [42].
Еще одним примером может служить экспертиза, при которой идентифицировались
останки двух погибших (Заключение эксперта № 2490 от 30.01.96 г.). Из
постановления было известно, что в багажнике сожженной машины были обнаружены
трупы двух неизвестных (мужчины и женщины) в сильной степени обугливания.
Предположительно, этими двумя неизвестными являлись мать и сын – Г. и Л. Трупы
были не опознаны.
Объекты поступили на исследование примерно через 2 недели после обнаружения
трупов. На экспертизу были представлены образцы различных тканей трупов, а также
образец крови отца Л. Мы исследовали: образцы тканей неизвестной женщины -
фрагмент скелетной мышцы и остатки мышечной ткани на поверхности одного из
ребер, фрагмент хрящевой ткани и фрагмент головного мозга; образцы тканей
неизвестного мужчины – фрагмент скелетной мышцы и остатки мышечной ткани на
поверхности бедренной кости, фрагмент головного мозга; образец крови отца Л.
Выделение ДНК проводили фенольным методом. Из всех перечисленных выше
образцов тканей неизвестных лиц выделена ДНК в деградированном состоянии.
Исследование проводили по 9 локусам - HLA-DQА1, «POLYMARKER», D1S80, D17S30, IgH.
По всем этим локусам удалось провести типирование останков обоих лиц. В
результате исследования было установлено, что: (а) генетическая характеристика,
выявленная при исследовании останков неизвестного мужчины, согласуется с
генотипом отца Л. таким образом, что отцовство последнего в отношении данного
лица не исключается; (б) генетическая характеристика, выявленная при
исследовании останков неизвестного мужчины, согласуется также с генетическими
признаками, выявленными при исследовании останков неизвестной женщины, таким
образом, что материнство ее в отношении данного лица не исключается; (в)
указанные отцовство и материнство не исключаются и при сопоставлении всех трех
генетических характеристик; вероятность случайного совпадения выявленных
признаков признаков составила 1 : 23041. Эти данные свидетельствовали в пользу
того, что представленные на исследование останки неизвестного мужчины могут
являться останками Л., а останки неизвестной женщины – останками Г.
Приведенные экспертизы показывают, что анализ ядерной ДНК, доступный в
обычных лабораториях ДНК-анализа, может быть весьма эффективным при
идентификации личности погибшего по останкам и его следует шире применять в
практике региональных лабораторий при производстве экспертиз по уголовным делам,
а в особенности - идентификационных исследований в связи со случаями терроризма,
катастроф и т.д., при которых имеющийся биологический материал имеет лишь
небольшую давность. Разумеется, для использования всего потенциала
ДНК-идентификации необходимо оснащение лабораторий автоматизированными системами
анализа (секвенаторами, приборами для капиллярного электрофореза), позволяющими
применять наиболее совершенные технологии исследования как ядерной, так и
митохондриальной ДНК. Тем не менее, отсутствие в лаборатории секвенатора не
должно являться причиной отказа от исследования по ядерным маркерам, тем более,
что материал в таких экспертизах обычно не ограничен в количественном отношении
и в случае отрицательного результата нет препятствий для последующего
исследования с помощью автоматизированных систем.
Исследование STR-локусов
Результаты исследования были использованы при подготовке методических
рекомендаций [16].
Оптимизация техники исследования
Важным моментом исследования являлось обеспечение достаточного разрешения
электрофоретической системы, что в особенности относилось к использованию
триплексов, а также монолокусных систем ТН01 и F13A01, требующих дифференциации
аллелей по 1 п.н.о. Использовали камеры для вертикального ПААГ размерами 21х40
см (BIORAD). Для сокращения времени исследования и расходования материалов
применяли различные варианты комплексного исследования триплексов и монолокусных
систем. Для отработки условий нанесения проб составлялись схемы, на которых
фиксировалось соотношение границ аллельного диапазона того или иного локуса с
положением маркерных красителей, продолжительностью электрофореза; отмечались
величина минимальных интераллельных промежутков, уровень расположения димеров
праймеров.
Изучение артефактов
К началу нашего исследования (1995 г.) вопросам диагностики артефактов при
STR-анализе были посвящены лишь отдельные зарубежные публикации (отечественные
отсутствовали), причем они касались, главным образом, флюоресцентного
автоматизированного анализа. Критерии, описываемые применительно к этой
технологии, не всегда были пригодны для той, которая доступна отечественным
экспертным лабораториям, что требовало соответствующего описания. За основу
классификации артефактов при STR-анализе мы взяли классификацию, приведенную в
работе Gill P. и соавт. [43] в отношении флюоресцентного анализа, изучив, как
она практически соотносится с использованной нами технологией.
В указанных выше методических рекомендациях [16] был проведен подробный
анализ разновидностей артефактов, встречающихся при STR-анализе. Мы не можем
согласиться с мнением Исаенко М.В., считающей, что наибольшую опасность для
интерпретации в экспертизе представляют артефакты, имитирующие аллельный лэддер
[44]. Охватывая полный аллельный диапазон локуса, эти артефакты слишком
очевидны, чтобы их можно было принять за истинные аллели. Столь большое
количество аллелей не характерно даже для «смешанных» объектов. Примечательно,
что в классификации Gill Р. и соавт. этот вид артефактов даже не упоминается,
хотя деградированная ДНК была в центре внимания этих исследователей. На наш
взгляд, объяснением этому служит то, что появление этого артефакта в
значительной степени зависит от свойств использованной Taq-полимеразы. В
зарубежной же практике, в частности в лаборатории, руководимой Питером Гиллом,
очень строго осуществляется отбор реагентов. Taq-полимераза, которая дает
подобную артефактную активность с деградированной ДНК, по-видимому, там просто
выбраковывается.
По нашему мнению, наибольшую опасность для интерпретации представляют
статтеры, «добавляющие» к профилю только 1-2 дополнительных фрагмента,
имитирующие аллельные. Это может вести как к ошибочному установлению
гетерозиготного состояния у гомозиготы, так и к установлению гетерогенного
характера образца, в действительности не содержащего смеси ДНК. Наши
исследования, проводимые в этом направлении, имели своей целью определить
критерии дифференциальной диагностики, актуальные именно для той технологии
STR-анализа, которая используется в отечественных лабораториях.
Что же касается артефактов типа "аллельного лэддера", то эти артефакты имеют
значение лишь в том отношении, что они могут приводить к отказу от интерпретации
профиля. Механизм возникновения этих артефактов, как и механизм возникновения
статтеров, по всей видимости, связан с ошибкой Taq-полимеразы, чем, скорее
всего, объясняется корреляция артефактной активности обоих типов. Так, в локусе
vWA с высоким уровнем статтеров наиболее часто наблюдается и артефакт,
имитирующий аллельный лэддер.
Монолокусная система позволяет добиться наибольшей оптимизации условий для
конкретного локуса, в связи с чем результат получается лучше. Триплексная
система оптимизировна под весь комплекс и не столь «индивидуальна». Это было
продемонстрировано нами экспериментально, при сравнительном исследовании локуса
vWA с использованием монолокусной и триплексной систем. В монолокусной системе
при очень четких и интенсивных сигналах аллельных фрагментов выраженность
статтеров была минимальна. Результат исследования тех же проб ДНК с
использованием триплексной системы показал значительно большую выраженность
статтерных фрагментов, чем при монолокусном анализе.
Возможность получения положительного результата типирования локуса
применительно к судебно-медицинским объектам зависит от целого ряда факторов, в
частности, от длины амплифицируемых последовательностей ДНК. Чем она меньше,
тем, теоретически, больше возможность получения положительного результата
амплификации. Длина амплифицируемых последовательностей рассматриваемых
STR-локусов представлена в порядке возрастания в следующем ряду: LPL, vWA, F13B,
TH01, FESFPS, TPOX, HPRTB, F13A01, CSF1PO. В то же время, на возможность
типирования могут влиять и другие факторы. Как было отмечено, неинтерпретируемым
могут сделать профиль артефакты типа "алелльного лэддера". Эффективность
исследования зависит и от иных моментов, которые можно проследить на данных,
получаемых с триплексами: здесь в одних и тех же условиях происходит
амплификация одной и той же матрицы по разным локусам. При исследовании
триплекса FFv интенсивность сигнала в локусе vWA, которому свойственны наиболее
короткие в этом триплексе аллельные фрагменты, как и ожидается, обычно больше,
чем в локусах F13A01 и FESFPS. Если же сравнивать между собой локусы F13A01 и
FESFPS, то интенсивность сигнала, полученного с некоторыми образцами при
исследовании локуса FESFPS, в ряде случаев в наших экспериментах оказывалась
несколько ниже, чем локуса F13A01, хотя длина аллельных фрагментов последнего
больше. В достаточно редких случаях в опытах отмечалась меньшая интенсивность
сигнала в локусе vWA. Это могло быть связано с различной сохранностью разных
участков матрицы, а также с некоторыми другими причинами.
Описанные наблюдения показывают неоднозначность оценки реальных
идентификационных возможностей разных локусов, а также проблему оптимизации
методов STR-анализа. Мы обобщили полученные нами результаты в следующих
рекомендациях по исследованию STR-локусов:
- Стратегия проведения STR-анализа в отношении последовательности
исследования локусов определяется особенностями объекта. Комплексный
(мультиплексный) STR-анализ имеет то преимущество, что с его помощью
одновременно проводится исследование нескольких локусов. В то же время,
монолокусный анализ может в ряде случаев обеспечить лучшие результаты. Поэтому
если количество и состояние объекта не оцениваются как лимитирующие факторы,
для обеспечения максимальной оперативности анализа целесообразно начинать
исследование с использования триплексов. К таким случаям относятся экспертизы
спорного отцовства, а также экспертизы вещественных доказательств, при которых
имеется достаточное количество материала и относительно удовлетворительное его
качество. Если количество исследуемой ДНК очень мало и/или она значительно
деградирована, целесообразно начинать исследование с монолокусных систем.
- Для уменьшения количества ДНК, необходимого для исследования (а также
количества реактивов), можно проводить ПЦР в меньшем объеме реакционной
смеси,чем это описано в протоколах (25 мкл), например, в половинном объеме,
1/3 объема. Работа с малыми объемами предъявляет особые требования к технике
исполнения исследования, использования высокоточных и хорошо отрегулированных
дозаторов, очень тщательного перемешивания компонентов. Это связано как с тем,
что погрешности исполнения процедуры при малых количествах не нивелируются,
так и со стохастическим эффектом.
- Важным принципом, который следует соблюдать при проверке реагентов для
судебно-медицинских исследований (и это справедливо не только для STR-локусов,
но и для других маркеров), должно стать использование в контрольных
исследованиях не только той матрицы ДНК, которая имеется в наборе, но и
"проблемной", деградированной ДНК.
- Предпочтительной техникой электрофореза для исследования
судебно-медицинских объектов является электрофорез в полиакриламидном геле с
детекцией фрагментов ДНК серебром. Окрашивание серебром обеспечивает более
высокую чувствительность детекции по сравнению с окрашиванием этидия бромидом
и имеет преимущества при исследовании объектов экспертизы. Это связано со
следующими обстоятельствами: (а) Для судебно-медицинской практики актуальна
проблема исследования микрообъектов, содержащих, соответственно, малые
количества ДНК и требующих высокой чувствительности методов; (б) Если даже
общее количество ДНК достаточно велико, то в условиях деградации ДНК,
характерной для судебно-медицинских объектов, недостаточно высоким может быть
удельный вес фрагментов, пригодных для амплификации, и это также требует
высокой чувствительности метода; (в) Объекты экспертизы могут быть
гетерогенны, и использование недостаточно чувствительного способа детекции
может привести к тому, что минорный компонент смеси может не выявиться.
Использование флюоресцентных красителей может служить альтернативой детекции
серебром, однако, это должен быть не этидия бромид, а более чувствительные
вещества. Например, представляет интерес возможность использования красителей
из группы SYBR (Molecular Probes).
- Необходимость высокого разрешения для разделения фрагментов, различающихся
по одному нуклеотидному основанию, использования мультиплексных систем,
предъявляет высокие требования ко всем составляющим электрофоретической
системы: (а) длине разгонки (оптимальной для обеспечения нужной длины разгонки
можно считать камеру длиной 40 см); (б) качеству электрофоретического
оборудования (адекватность технических характеристик оборудования задаваемым
параметрам высокого напряжения и т.д., стабильность системы, обеспечение
равномерности электрического поля); (в) качеству акриламида (требуется
4-кристаллический акриламид для секвенирования) и другим реагентам,
используемым для электрофореза. Большая разгонка при судебно-медицинских
исследованиях необходима не только для обеспечения достаточного разрешения
аллельных фрагментов. Если даже условия ПЦР полностью оптимизованы в
эксперименте, в случае исследования деградированной ДНК пропорция фрагментов,
пригодных для типирования в данной пробе, неизвестна. Поскольку это может
привести к несбалансированности в реакционной смеси количеств праймеров и
матрицы, возможно образование низкомолекулярных фрагментов (димеров праймеров),
которые в случае недостаточной разгонки могут оказаться в аллельном диапазоне
другого локуса, затрудняя учет результатов. В связи с этим, условия исполнения
метода (последовательность нанесения проб, исследуемых по разным локусам и
интервалы между нанесением) требуют тщательной технической отработки для
конкретной электрофоретической системы.
Практические рекомендации по исследованию ДНК с выраженной деградацией, а
также по исследованию "смешанных" следов были систематизированы нами в
методических рекомендациях [16].
Соотнесение "традиционных" методов исследования и ДНК-анализа
С развитием ДНК-анализа важным становится вопрос о месте новых и традиционных
методов исследования идентификационных генетических маркеров в экспертном
комплексе. Выбор методов и последовательность их применения в той или иной
экспертизе должны определяться задачами экспертизы с учетом ее категории
(первичная, дополнительная, повторная). Прежде чем начинать работу
непосредственно с объектами, обязателен анализ всех исходных данных, включая
обстоятельства дела, результаты ранее проведенных экспертиз, характер имеющихся
следов и т.д. До начала исследования полиморфных генетических маркеров,
независимо от того, какими методами оно проводится (традиционными или с
использованием ДНК-анализа), необходимо тщательное определение природы пятна,
что крайне важно для интерпретации результатов исследования, в особенности, в
случае "смешанных" следов. На практике применительно к данным исследованиям эти
общие принципы соблюдаются далеко не всегда. Между тем, значимость всех
указанных выше этапов исследования в экспертном комплексе с введением методов
анализа ДНК не только не уменьшается, но и приобретает еще большее значение. Это
объясняется тем, что структура экспертизы становится все более сложной,
идентификационная значимость результатов возрастает, поэтому последствия
неправильной экспертной тактики, а тем более ошибок, все более серьезны.
Методы исследования ДНК имеют целый ряд очевидных преимуществ перед
традиционными методами исследования идентификационных генетических маркеров. К
ним, в частности, можно отнести: (1) В целом, более высокую информативность. (2)
Возможность проводить в едином комплексе исследование значительного числа
генетических маркеров, в том числе, различных по их экспертной функции
(например, маркеров полиморфных локусов и маркеров генетического пола); это не
только методически удобно, но и обеспечивает экономное расходование экспертного
материала и максимальную сопоставимость результатов исследования. (3) Применение
праймеров, специфичных для ДНК человека, позволяет избежать актуальной для
иммунологических методов проблемы ложноположительных результатов вследствие
микробного загрязнения. (4) Вещества, содержащиеся в предмете-носителе, в ряде
случаев могут приводить к отрицательному результату типирования за счет
ингибирования ПЦР. Однако в иммунологических методах влияние предмета-носителя
может создавать риск получения ложноположительного результата, что более опасно.
(5) Результаты ДНК-анализа наглядны; легко документируются, что позволяет
сохранить первичные материалы и представить их в суд. Это обеспечивает высокую
достоверность данных, а следовательно, повышает ценность экспертного заключения
как судебного доказательства. (6) Методы исследования ДНК хорошо поддаются
автоматизации; тем самым обеспечивается высокая пропускная способность метода,
стандартность выполнения процедуры, сведение к минимуму риска ошибок за счет
субъективного фактора. Все это служит аргументом в пользу того, чтобы методы
ДНК-анализа занимали важное место в структуре экспертизы, а в идеале –
использовались во всех случаях, когда решается вопрос об источнике происхождения
объекта или о генетическом родстве.
Это не означает, однако, что методы исследования изосерологических и других
традиционно исследуемых маркеров утрачивают свое значение. В условиях, когда
большая часть экспертных лабораторий не имеет возможности использовать
ДНК-анализ, необходимость применения этих методов очевидна. Но дело не только в
практической стороне вопроса. Актуальность этих методов остается, даже если
рассматривать проблему только в методическом аспекте: (1) Свойства экспертных
объектов многообразны и не может быть "универсальной" результативности метода -
даже столь эффективного, как ДНК-анализ. Традиционные исследования могут
оказаться полезны, например, при ингибировании ПЦР. (2) Каждый метод имеет свои
особенности, и знание их может помочь эксперту извлечь максимум возможностей из
исследования. Так, если говорить о диагностике генетического пола, то
цитологический метод исследования, по многим позициям уступающий ПЦР-анализу,
имеет и свои сильные стороны. В частности, он обеспечивает не только выявление
исследуемого генетического маркера, но и установление природы его носителя
(например, позволяет отнести его выявление непосредственно за счет крови,
буккального эпителия и т.д.), что является важным в случае "смешанных" следов. В
отличие от этого, при ДНК-анализе генетический профиль выявляется
безотносительно к источнику его происхождения. (3) Использование сочетаний
разных видов методов может быть целесообразным с точки зрения сроков выполнения
исследования. Например, исследование в экспертизе спорного отцовства до
проведения ДНК-анализа не только системы АВО, но и с помощью поликатионного
метода антигенов ряда других систем, может обеспечить экспресс-диагностику целой
серии изосерологических маркеров, и уже на этой основе экспертом будет
определяться дальнейшая тактика экспертизы. (4) Следует учитывать значение АВО
как источника не только доказательственной, но и поисковой информации.
Все это позволяет сделать вывод о том, что экспертный методический комплекс
должен быть ориентирован на исследование разных типов генетических маркеров на
основе оптимальной для каждого случая стратегии экспертизы.
Анализ возможных направлений дальнейшего развития в области исследования
генетических идентификационных маркеров
Перспективы разработки ДНК-идентификации могут быть рассмотрены в двух
аспектах. Один из них связан с совершенствованием уже существующей системы
ДНК-идентификации и дальнейшим изучением вопросов, актуальных для решения ее
сегодняшних задач. Другой аспект связан с новыми направлениями развития этой
технологии. В целом, разработка ДНК- идентификации видится в следующем.
Совершенствование методической части исследования применительно к типированию
уже используемых генетических маркеров: (а) минимизация количества необходимого
для исследования биологического материала; (б) изучение природы ингибирующих ПЦР
субстанций и разработка эффективных методов устранения ингибирующих влияний; (в)
оптимизация подходов к исследованию объектов разного происхождения; (г)
эффективное решение проблемы исследования гетерогенного генетического материала.
Изучение новых локусов, перспективных для идентификационных исследований. Для
того, чтобы исследование этих локусов было введено в практику ДНК-идентификации,
они должны иметь преимущества перед теми, которые используются в настоящее
время, в следующих отношениях: (а) обеспечивать возможность исследования ДНК с
более выраженной деградацией; (б) сводить к минимуму артефакты; (в) обеспечивать
более высокую чувствительность; (г) обладать более высокой информативностью; (д)
обеспечивать большие возможности в комплексировании с методами исследования
других локусов; (е) иметь методические преимущества в удобстве исполнения,
продолжительности исследования, трудоемкости процедуры и т.д.
Автоматизация всех этапов исследования ДНК с возможно полной реализацией
преимуществ применения автоматизированных методов и преодолением его негативных
сторон.
Широкомасштабный популяционный анализ и выработка научно обоснованных
критериев для максимально точного выбора для ДНК-идентификации популяционных
параметров.
Совершенствование математического аппарата для вероятностно-статистической
интерпретации генетических данных. Принятие решения в отношении критерия
достоверности ДНК-идентификации.
Формирование национальных и международных информационных компьютерных систем
ДНК-регистрации.
Разработка методологии экспертизы вещественных доказательств как экспертизы,
сочетающей традиционные методы исследования и ДНК-анализ. Важность рассмотрения
ДНК-анализа в рамках всей экспертизы вещественных доказательств подчеркивалась
нами выше. В данном случае речь идет о целесообразном сочетании применения
методов в экспертизе как с точки зрения чисто методической стороны, так и с
учетом условий, в которых осуществляется исследование. Последний момент в
особенности важен для отечественной экспертной практики, имеющей серьезные
ограничения в возможностях применения ДНК-анализа, что часто не позволяет
ориентироваться лишь на эффективность методов. Нельзя не учитывать здесь и такие
моменты, как финансовые, организационные и т.д. Рассматривая ДНК-анализ с этих
позиций, понятно, что место других методов в структуре экспертизы в
отечественной практике больше, чем это имеет место за рубежом. В связи с этим,
нельзя слепо брать на вооружение зарубежные модели, которые часто, практически,
совпадают с "идеальными", строясь на чисто научных предпосылках. Так, например,
в ряде европейских стран проведение ДНК-анализа предпринимается непосредственно
после установления наличия крови и определения ее видовой принадлежности, минуя,
в частности, исследование системы АВО. Для нашей страны такой путь мало приемлем
в силу финансовых причин, поэтому даже в тех лабораториях, в которых
используется ДНК-анализ, исследование традиционных полиморфных маркеров остается
актуальным. В большинстве региональных лабораторий ДНК пока не исследуется. Это
не значит, однако, что исследования в них должна вестись так, как будто этого
метода не существует и не учитываться возможность выполнения ДНК-анализа в
других учреждениях. Определение для этих случаев порядка проведения экспертизы
является вопросом не только организационным, но и методическим. Отметим также,
что сложность судебно-медицинских объектов может делать целесообразным
применение различных групп методов.
Интегрирование ДНК-идентификации в общую систему поиска и оценки
доказательств по факту правонарушения. Комплексная разработка методологии
идентификации применительно ко всей совокупности методов судебной медицины и
криминалистики и определение места ДНК-анализа в этом комплексе. Как сочетается
ДНК-анализ с другими методами? Как следует использовать экспертный материал?
Какова интерпретация данных различных экспертиз, проведенных в связи с
исследованием одного и того же объекта? Какова оптимальная схема экспертного
исследования?
Разработка комплекса общих положений, связанных с осуществлением
ДНК-идентификации: программ обеспечения и контроля качества исследований;
правовых вопросов для регулирования допустимых границ и способов использования
генетической информации; этических вопросов, рассматриваемых не только в
контексте общих гуманитарных представлений, но и с учетом особенностей,
характерных для менталитета жителей страны, и принятых в обществе ценностей.
Указанные направления, в той или иной степени, разрабатываются в науке в
настоящее время. Что касается перспективы, то можно ожидать развития следующих
направлений.
Создание «фенотипического портрета». Расшифровка генома человека, вероятно,
позволит выйти за рамки исследования “невидимых” генетических маркеров и даст
возможность устанавливать фенотипически проявляющиеся генетические особенности
индивидуума: рост, конституциональные особенности скелета, признаки внешности
(цвет глаз, волос и пр.), расовую принадлежность, генетические особенности,
характерные для этнической принадлежности индивидуума, и т.д. В связи с большими
размерами генов, делающими их не пригодными для исследования в судебной медицине
в целостном виде, речь, по всей видимости, будет идти об исследовании
сравнительно низкомолекулярных участков, сцепленных с этими генами и маркирующих
их. Сложность практического исследования таких признаков, однако, будет
обусловлена необходимостью учета всех моментов, связанных с реализацией
генетических признаков в фенотипе.
Изучение медицинского статуса индивидуума может явиться другой возможной
ветвью развития указанного выше направления. Предпосылкой смогут служить данные,
полученные в последние годы в области молекулярной медицинской генетики.
Показано, что целый ряд генов, ответственных за наследственные заболевания,
имеет сцепленность с низкомолекулярными гипервариабельными маркерами, к числу
которых относятся, в частности, STR-локусы [45]. Типирование таких участков в
судебно-медицинских объектах не представляет методических сложностей и,
применительно к другим подобным локусам, широко используется в
ДНК-идентификации. Однако, если в настоящее время для судебно-медицинского
типирования отбираются локусы, не сцепленные с какими-либо заболеваниями, то в
данном случае задача состоит в том, чтобы определить спектр полиморфных
маркеров, имеющих такое сцепление. При наличии у проходящего по делу лица
заболевания, имеющего известный генетический маркер, обнаружение такого же
признака в исследуемом объекте будет иметь важное доказательственное значение
при установлении тождества. Такие признаки будут иметь и поисковое значение:
обнаружение в объекте маркера того или иного заболевания может быть
информативным на этапе расследования. Важным моментом здесь явится оценка
клинической значимости выявленных генетических маркеров, их прогностического
значения для реализации в фенотипе.
Изучение признаков, связанных с психологической конституцией. Психическая
деятельность, как и соматический статус, имеет генетическую основу, хотя
определяется и множеством других факторов, помимо генетических. Сложностью
практического воплощения этой идеи является также полигенный характер таких
признаков. Тем не менее, для судебной медицины здесь видятся две возможности:
(а) изучение маркеров психических заболеваний, влияющих на психологические
особенности, и (б) изучение других тонких генетических механизмов,
детерминирующих интеллект, способность к обучению, предрасположенность к
определенным видам умственной деятельности, особенности реагирования и т.д.
Представляется, что несмотря на большие сложности, при правильной методологии
исследования и взвешенном подходе к интерпретации данных в научном плане
проблема, в той или иной степени, в будущем станет решаться. Генетика поведения
человека изучается уже сравнительно давно. Например, систематизированный обзор
имеющихся представлений в этой области дан в монографии [46].
Возможность ассоциации криминалистических признаков с особенностями
психологической и физической конституции крайне привлекательна для
криминалистики и рассматривается в рамках разных направлений, например
почерковедения или дактилоскопии. Так, в монографии "Статистическая
дактилоскопия" [47] описаны результаты исследований, свидетельствующих о связи
конституции индивидуума с характером папиллярных узоров. Установлено, что низкий
дельтовый коэффициент присущ элитным спортсменам со скоростно-силовыми
качествами, средний коэффициент свидетельствует о выносливости, высокий - о
способности к сложно координируемой деятельности. Высокий дельтовый коэффициент,
кроме того, свойственен лицам, способным к активной творческой работе, к
вариабельности действий. Напротив, низкий коэффициент чаще всего связан с более
прямолинейным мышлением.
Весьма интригующей является возможность выявления признаков, ассоциируемых с
психологическими особенностями, которые могут рассматриваться как
предрасполагающие к совершению противоправных действий, например, агрессивность.
Несмотря на скепсис, неминуемо сопровождающий попытки поиска маркеров
"криминальности", начало изучения которых относится уже к ранним этапам развития
судебно-медицинской науки, и их суровую критику, интерес к этой проблеме, вне
всякого сомнения, имеет основания. В формировании склада личности преступника не
могут не играть роли генетические факторы, и вопрос, таким образом, состоит в
отсеве случайных признаков и выявлении существенных из них, а также в
установлении факта реализации этих особенностей. В цитированной выше монографии
приводится ссылка на исследование, в ходе которого установлена значительно более
высокая частота встречаемости одного из признаков папиллярного узора (асимметрия
гребневого счета на правой и левой руках) в группе серийных убийц по сравнению с
контрольной группой - 94,1% против 22,95%. Признаки, подобные этим, несомненно,
детерминируются на уровне ДНК и изучение их представляет большой интерес.
Разработка указанных выше направлений, связанных с исследованием кодирующих
областей ДНК, затрагивает права личности, поэтому здесь остро встает вопрос о
правовых и этических основаниях. Таким образом, учитывая потенциальный интерес
криминологов и криминалистов к этой проблеме, разработкам в этой области, а тем
более, практическому использованию их результатов, должно предшествовать строгое
правовое урегулирование.
Интерес может представить установление генетической природы признаков,
изучаемых с помощью других методов судебной медицины и криминалистики, например,
папиллярных узоров, особенностей почерка, одорологических признаков и т.д.
Помимо общенаучного интереса в познании таких взаимосвязей, изучение их может
помочь внести существенные уточнения в оценку этих признаков, разработать новые
критерии достоверности и т.д.
Применение методов судебно-медицинского ДНК-анализа в других областях. Науки
взаимно обогащаются. Судебно-медицинский ДНК-анализ, находясь на стыке различных
наук, аккумулирует достижения в этих областях. Но судебно-медицинская
ДНК-идентификация может быть не только потребителем, но и источником данных для
других отраслей. Например, определенный интерес в общенаучном плане могут
представлять наблюдения, касающиеся исследования измененных объектов;
методические приемы работы с микроколичествами биологического материала могут
оказаться полезным для медицинской диагностики, и т.д.
Перечисленные здесь направления развития судебно-медицинской
ДНК-идентификации существенно различаются по возможности их реализации. Одни из
них, связанные с дальнейшим совершенствованием технологии исследования
гипервариабельных некодирующих областей, имеют реальные перспективы
осуществления и, в той или иной степени, разрабатываются в настоящее время. Что
касается изучения кодирующих областей, связанных с «фенотипическим портретом»,
то возможность разработки этих направлений относится к весьма отдаленной
перспективе. Некоторые из них, например, касающиеся изучения психологических
особенностей личности, вообще представляются пока чисто гипотетическими. Прежде
чем любое из этих направлений начнет реализовываться в судебной медицине и
криминалистике, должны быть получены фундаментальные знания в отношении
соответствующих молекулярных структур и функциональных механизмов, что будет
достигнуто, видимо, еще не скоро. Однако и при условии, что это будет
осуществлено, использование таких данных в экспертизе будет представлять большие
сложности, прежде всего, в связи с тем, что ее объекты всегда содержат не весь
массив генетической информации, свойственной индивидууму, а лишь ее фрагменты, а
также в связи с особенностями, присущими носителям этой информации in vitro.
Тем не менее, мы сочли целесообразным упомянуть и эти направления, поскольку
в перспективе, возможно, они будут разрабатываться. Накопление научных знаний в
области изучения генетической конституции человека будет все более и более
расширять возможности такой важнейшей прикладной дисциплины, какой является
экспертиза вещественных доказательств, с целью использования ее данных для
расследования и раскрытия преступлений.
2. ИЗУЧЕНИЕ ВОПРОСОВ ВЕРОЯТНОСТНО-СТАТИСТИЧЕСКОГО АНАЛИЗА ДАННЫХ
ГЕНЕТИЧЕСКОЙ ИДЕНТИФИКАЦИИ И РАЗРАБОТКА ЭКСПЕРТНЫХ АЛГОРИТМОВ ВЫЧИСЛЕНИЯ
ВЕРОЯТНОСТЕЙ
Выявление в результате генетического анализа комплекса идентификационных
признаков информативно в той мере, что оно исключает, либо, наоборот, допускает
возможность генетического тождества или генетического родства. В последнем
случае информативность результата исследования необходимо оценить математически.
Проведенные разработки в области вероятностно-статистической интерпретации
генетических данных были продиктованы необходимостью обеспечения экспертной
службы методическими материалами, содержащими пригодные для практики методики
проведения вероятностных расчетов.
2.1. Описание понятий ДНК-идентификации в терминах теории вероятностей и
математической статистики
Применение в ДНК-идентификации положений теории вероятностей и математической
статистики требует «приведения к общему знаменателю» используемых понятий.
Рассмотрим характер выявления генетических признаков (аллеля или генотипа),
относящихся к отдельному локусу. С точки зрения теории вероятностей выявление в
популяции какого-либо генетического признака есть событие случайное. То, что у
наугад выбранного из популяции индивидуума окажется именно данный генетический
признак, непредсказуемо. В этом смысле выявление определенного генетического
признака совершенно аналогично выбрасыванию какого-либо числа очков при игре в
кости или вытягиванию карты из колоды. Например, при вытягивании карты могут
появиться шестерка, семерка, валет и т.д. Если только это не карточный фокус, то
заранее определить карту, которая сейчас будет вытянута, нельзя, поскольку это
зависит от множества случайных причин, которые нельзя учесть.
В отличие, однако, от этих примеров, выявление у наугад выбранного из
популяции индивидуума того или иного генетического признака не относится к
равновозможным событиям. События называют равновозможными, если есть основания
считать, что ни одно из них не имеет больших возможностей для осуществления, чем
другие. Что же касается генетических признаков, то существуют некие причины, в
силу которых в популяции одни генетические признаки встречаются чаще других
(иногда – в десятки и сотни раз). Поэтому шанс выявления у индивидуума часто
встречающихся признаков больше, чем выявления редко встречающихся признаков.
Следовательно, эти события не являются равновозможными.
В теории вероятностей события называются несовместными, если появление одного
из них исключает появление другого события в одном и том же испытании.
Применительно к генетическим признакам, выявление у наугад выбранного
индивидуума какого-либо генотипа – несовместное событие по отношению к выявлению
других генотипов, поскольку у человека может быть только один генотип.
Этого, однако, нельзя безоговорочно сказать об аллелях. Если речь идет о
локусе конкретной гомологичной хромосомы, то выявление одного аллеля является
несовместным событием по отношению к выявлению в нем какого-либо другого аллеля.
Аллели занимают в хромосоме один и тот же локус и взаимно исключают друг друга.
Если у индивидуума данный локус конкретной хромосомы занят одним аллелем, то он
не может быть занят другим. Однако если говорить о локусе безотносительно к
определенной хромосоме, то есть иметь в виду соответствующие участки обеих
гомологичных хромосом в целом, то присутствие одного аллеля (на одной из
гомологичных хромосом) не исключает присутствия другого (на другой гомологичной
хромосоме). В случае гетерозиготы выявление одного аллельного варианта в локусе
не является несовместным событием по отношению к выявлению какого-либо другого
аллельного варианта. Так, аллель 1, расположенный на одной гомологичной
хромосоме, может сочетаться с каким угодно другим аллелем – 2, 3 и т.д.,
расположенном на другой гомологичной хромосоме. В то же время, если у
индивидуума гомозиготный генотип, то это, по определению, исключает присутствие
в его генотипе какого-либо иного аллельного варианта. Таким образом, выявление у
гомозиготного (по данному локусу) индивидуума какого-либо аллельного варианта
является несовместным событием по отношению к выявлению другого аллельного
варианта; выявление у гетерозиготного индивидуума какого-либо аллеля не является
несовместным событием относительно выявления другого аллеля.
Если рассматривать аллели в популяционном отношении, то совокупность всех
аллелей локуса образуют полную группу. Несколько событий образуют полную группу,
если в результате испытания обязательно происходит только одно из событий этой
совокупности. Если тестировать одну отдельно взятую гомологичную хромосому, то в
интересующем локусе обязательно выявится какой-либо из аллелей, причем только
один. Сумма вероятностей событий, образующих полную группу, равна единице.
Следовательно, вероятность всех аллелей локуса равна единице. Если в локусе n
аллелей, то это выражение запишется следующим образом:
р1 + р2 + … + рn = 1, где
рi — вероятность i-го аллеля.
Аллели являются дискретными единицами. В структурном отношении аллелю присущи
строго определенные количественные характеристики: количество нуклеотидов;
характер распределения нуклеотидов, который может быть описан количественно
определенным образом; число повторяющихся субъединиц в составе аллеля.
Дискретность проявляется также в характере наследования: аллели наследуются как
дискретные единицы. Вероятности аллелей, соответственно, подчиняются законам
распределения вероятностей дискретных случайных величин.
Вероятность pa есть вероятность нахождения аллеля а
в одной, конкретной хромосоме. Вероятность присутствия у индивидуума аллеля
а хотя бы в одной из парных хромосом, обозначается qa.
Вероятность qa находят на основании данных
популяционных исследований. Для этого подсчитывают qa(N)
- частоту нахождения аллеля а в данном локусе ДНК, равную отношению числа проб (Nа),
в которых был выявлен аллель а, к общему числу исследованных проб
(N):
qа(N) = Na /N.
Рассмотрим вероятность, изучаемую при ДНК-идентификации, с точки зрения
различных определений вероятности. Согласно классическому определению,
вероятность события А – это отношение числа элементарных событий m,
благоприятствующих событию А, к общему числу всех элементарных событий n:
P(A) = m/n. Элементарным событием называется каждый из возможных
результатов испытания.
Классическое определение имеет ряд ограничений. Одним из них является то, что
это определение предполагает, что число элементарных исходов испытания конечно;
на практике же весьма часто встречаются испытания, число возможных исходов
которых бесконечно. Поскольку идеей ДНК-идентификации является решение вопроса о
происхождении объекта от какого-то индивидуума, очевидно, что число элементарных
исходов испытания является числом конечным – равным, самое большее, численности
населения Земли. В этом смысле классическое определение вероятности
применительно к вероятности генетических признаков является удовлетворительным.
Более существенным моментом является то, что классическое определение
вероятности предполагает, что элементарные события равновозможны. Поскольку, как
это установлено выше, генетические признаки не являются равновозможными, следует
обратиться к другому определению вероятности. Значительно более приемлемым
является статистическое определение: в качестве статистической вероятности
события принимают относительную частоту или число, близкое к ней. Именно
статистическая вероятность реально используется в практике. В общем виде
относительной частотой события называют отношение числа испытаний, в которых
событие появилось, к общему числу фактически произведенных испытаний:
W(A) = m/n, где W(A) – относительная частота
события А, m – число появлений события А, n – общее
число испытаний.
Выражение qа(N) = Na /N соответствует
статистическому определению вероятности. В нашем случае событием А
является выявление у случайно выбранного из популяции индивидуума изучаемого
аллеля a, относительная частота W(A) – частота нахождения аллеля a
в данном локусе (в наших обозначениях - qа(N)), m –
число проб (Nа), в которых был выявлен аллель a,
n - общее число исследованных проб (N).
Как и в других случаях, статистическая вероятность, рассмотренная
применительно к ДНК-идентификации, удовлетворяет требованиям, которые необходимы
для существования статистической вероятности события: а) возможность, хотя бы
принципиально, производить неограниченное число испытаний, в каждом из которых
событие наступает или не наступает; б) устойчивость относительных частот
появления события в различных сериях достаточно большого числа испытаний. Если
N велико, то, по закону больших чисел, частота qa(N)
практически совпадает с вероятностью qa.
С целью получения данных о частоте встречаемости генетических признаков в
популяции используется выборочный метод математической статистики. При
популяционных исследованиях ДНК выборочный метод является единственно возможным,
поскольку большие размеры популяций и высокая стоимость ДНК-анализа делают
практически не осуществимым проведение сплошного исследования, то есть
обследования всей популяции. Это возможно лишь в крайне редких случаях
обследования малых популяций (например, изолятов).
Как бы ни была мала величина вероятность случайного совпадения Р,
она, тем не менее, никогда не будет равна нулю. В связи с этим, генетическая
идентичность анализируемого экспертного объекта и сравниваемого с ним образца
всегда является гипотезой. В терминах математической статистики эта гипотеза
Н0 является нулевой, или основной. Наряду с выдвинутой
гипотезой Н0 существует и противоречащая ей гипотеза
Н1 – конкурирующая, или альтернативная гипотеза. Если
Н0 - это гипотеза о генетической идентичности сравниваемых
объектов, то гипотеза Н1 – это гипотеза об отсутствии
генетической идентичности этих объектов. В качестве Н0
гипотезы может выступить и отрицающая гипотеза. Например, в экспертизе иногда
используется индекс исключения отцовства; соответствующая нулевая гипотеза в
этом случае – гипотеза об отсутствии генетического родства между ребенком и
предполагаемым отцом. Такая ситуация, однако, бывает редко, обычно нулевая
гипотеза - позитивна.
В ходе рассмотрения выдвинутой гипотезы может быть принято либо правильное,
либо неправильное решение. Правильное решение будет принято в двух случаях:
1) гипотеза Н0 принимается, причем и в
действительности она является правильной;
2) гипотеза Н0 отвергается, причем и в действительности
она неверна.
Неправильное решение в отношении гипотезы Н0
сопряжено с ошибками двух родов:
-
Ошибка первого рода состоит в том, что будет не принята
правильная гипотеза. В результате генетического исследования получено
совпадение профилей ДНК анализируемого объекта и сравниваемого с ним образца,
однако вывод о генетической идентичности этих объектов (которая в
действительности имеет место) не делается, поскольку исследователем
допускается возможность того, что произошло лишь случайное совпадение профилей
ДНК в пределах исследованных локусов. В реальной ситуации это означает, что
исследователь не рискнул сделать категорический вывод о происхождении
изученного им объекта от конкретного лица, используя более осторожную,
вероятностную формулировку. Поскольку в действительности объект произошел от
этого лица, имеет место недооценка полученных данных.
-
Ошибка второго рода состоит в том, что будет принята
неправильная гипотеза. В реальности исследованный объект, например след крови,
не произошел от подозреваемого и профиль ДНК следа крови совпал с генотипом
подозреваемого по исследованным локусам случайно. Делая ошибочный вывод о
генетической идентичности сравниваемых объектов, исследователь переоценивает
полученные им данные.
Последствия ошибок первого и второго рода обсуждаются нами в [48].
2.2. Подход к построению математической модели для
вероятностно-статистического анализа данных ДНК-идентификации
Построение математической модели для ДНК-идентификации имеет два аспекта.
Конкретная модель строится экспертом в каждом исследовании для того, чтобы
выбрать соответствующий алгоритм вероятностных расчетов. Для разработки этих
алгоритмов необходима некая общая математическая модель ДНК-идентификации,
которая позволит выделить существенные стороны анализа и отразить их в комплексе
разрабатываемых алгоритмов.
Особенности построения и использования математических моделей для
судебно-медицинской ДНК-идентификации обусловлены, в основном, тремя
обстоятельствами:
Многообразием экспертных ситуаций
Известно, что чем сложнее рассматриваемое явление, тем труднее построить его
точную математическую модель. Кроме того, сложное явление порождает сложную
математическая модель. Однако слишком сложные математические модели чрезмерно
громоздки и не имеют практической ценности. В этом состоит противоречие между
реалистичностью модели и возможностью оперировать ею. Очень точное описание всех
известных фактов не позволит выполнить полезные вычисления или осуществить
прогнозирование. В то же время, чрезмерно упрощенная математическая модель
позволит легко провести математическую обработку данных, однако результат ее
будет неточен, поскольку будут опущены некоторые существенные факты (Бейли Н.,
1970). Эта дилемма, хотя и не специфична для ДНК-идентификации, принимает здесь
весьма острую форму.
Неопределенностью ситуаций
Экспертные ситуации отличаются не только большим
разнообразием, но и тем, что априори эксперту об объекте почти ничего не
известно. Поскольку, однако, математическая модель предназначена для описания
определенных аспектов реальной действительности, результаты применения модели
существенно зависят от точности этого изображения.
В экспертизе исследование представляет собой многоступенчатый процесс, в котором
одни данные являются основанием для получения других и одно доказательство
служит основой доказательства следующего факта. Для того, чтобы идентифицировать
индивидуума, который оставил свои следы на месте происшествия, эксперт проходит
путь от определения природы объекта до констатации его генетического тождества
со сравниваемым объектом, получив последовательно целую совокупность данных.
Однако с целью максимальной конкретизации модели при ее
построении следует ограничиться использованием только тех данных, которые
получены в результате непосредственно исследования ДНК. Это не означает, что
более ранние этапы исследования не должны найти отражения в математической
обработке результатов. Речь идет о лишь том, чтобы математическая обработка
проводилась на основе окончательной экспертной генетической модели, которая
формируется экспертом в результате всех выполненных им этапов исследования. На
выходе же такого исследования получается генетический профиль, который
оценивается экспертом с точки зрения идентичности генетическому профилю
определенного индивидуума, либо с точки зрения установления генетического
родства. Это значительно упрощает математическую модель, обеспечивая, в то же
время, ее корректность. Точность же ее зависит от того, в какой степени эксперт
учел данные, полученные на всех этапах исследования. Например, генетический
профиль может рассматриваться и с точки зрения происхождения его за счет ДНК
одного индивидуума, и с точки зрения происхождения за счет ДНК разных лиц.
Математическая обработка результатов в этих случаях, а также основной вывод по
экспертизе будут различными. Для решения данного вопроса эксперт должен не
только правильно интерпретировать данные ДНК-анализа, но и учесть результаты
других исследований, имеющих значение в данном случае (например,
цитологического, микроспектрального и т.д.), а также других экспертных действий
(изучение обстоятельств дела, локализации следов, их характера и т.д.).
Необходимостью одновременного использования большого арсенала знаний,
относящихся к разным дисциплинам
Для успешной работы в области ДНК-идентификации требуется сочетание таких
составляющих, как: а) понимание генетических аспектов исследования; б) умение
выявить особенности, отличающие судебно-медицинский объект от "идеального"
объекта молекулярно-генетического исследования, и рассмотрение его в контексте
конкретной экспертизы; в) знание в необходимом объеме теории вероятностей и
математической статистики и умение применить их для анализа конкретного
экспертного случая.
Если сочетание функций судебного медика и генетика с большим или меньшим
успехом, но постоянно реализуется в экспертной практике, то сочетание
компетентности в этих науках и высшей математике – задача значительно более
сложная, хотя бы вследствие существенной разницы в базовом образовании,
соответствующем этим дисциплинам. На этапе разработки методов эта проблема
решается посредством сотрудничества специалистов разного профиля. Однако
проблема «стыка наук» не завершается разработкой метода. Эксперту, не имеющему
профессиональной подготовки в области математики, необходимо будет применять
метод ко множеству самых разнообразных ситуаций, всю совокупность которых
детально описать невозможно в рамках какой угодно самой совершенной модели. В
случае необходимости он должен также представить свое исследование в зале суда,
сумев при этом дать объяснение всем нюансам исследования, в т.ч. и
математической обработки данных. Это обстоятельство является, наряду с другими,
очень важным и его нельзя упускать из виду при создании методического базиса
вероятностно-статистического анализа, предназначенного для внедрения в
экспертную деятельность. При разработке системы математической интерпретации
следует соотносить ее с существующими условиями экспертной и судебной практики.
Как видно из этих рассуждений, условием создания жизнеспособной и
функциональной математической модели при ДНК-идентификации является ее
сбалансированность в смысле объема и необходимости исходной информации, а также
адекватность условиям ее применения.
2.3. Разработка экспертных алгоритмов вероятностно-статистического анализа
данных генетического исследования
Ниже приводится разработанный нами комплекс экспертных алгоритмов для
вероятностно-статистического анализа данных генетического идентификационного
исследования на основе классического метода математической статистики.
Подчеркнем, что, говоря о разработке данной темы, мы имеем в виду разработку не
математических вопросов как таковых (формулы базируются на известном методе
математической статистики), а целостной экспертной системы
вероятностно-статистической интерпретации данных, методического подхода к
проведению этого этапа экспертного анализа и техники выполнения расчетов,
которая реально пригодна для экспертной практики.
Решение вопроса о тождестве. При исследовании объектов, содержащих ДНК одного
индивидуума, экспертный алгоритм включает в себя вычисление Р для
гомозиготного и гетерозиготного профилей, а также для случая, когда допускается
выявление в исследуемом объекте (за счет преимущественной амплификации) неполной
аллельной характеристики (табл. 5).
На этапе, когда эксперты в силу технических причин испытывали затруднения с
идентификацией аллелей, мы разработали для них специальный алгоритм для
вычисления средних вероятностных величин Рср., который
включил в себя несколько вариантов расчетов.
Для гомозиготного профиля:
Рср. =
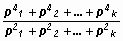 .
.
Для гетерозиготного состояния аллелей рекомендовали две формулы, в
зависимости от того, как располагались выявленные аллели по отношению к маркеру
величины фрагментов. Если выявленные аллели находились в одной и той же
детектируемой области: (1® k), то
расчет вели по формуле:
Рср. = 2
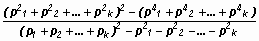 .
.
Если аллели находились в разных областях: (1®
k) и (N® l), то Рср.
вычисляли по формуле:
Рср. = 2 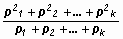 х
х
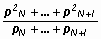 .
.
Таблица 5
Вероятностные расчеты при установлении тождества сравниваемых объектов
(предполагается, что генетический профиль произошел за счет ДНК одного
индивидуума)
|
Модель 1
(гомозиготный профиль) |
Модель 2
(гетерозиготный профиль) |
Модель 3
(допускается возможность получения неполной аллельной характеристики Х) |
|
Х П
а _____ _____
P=p2a |
Х П
а _____ _____
b _____ _____
P=2papb |
Х П
а _____
b _____ _____
Р=pa(2-pa) |
Обозначения: Х – исследуемый экспертный объект, П – образец проходящего по
делу лица. Полосы обозначают выявленные аллели.
Более сложным экспертным случаем являются ситуации, когда известно или
предполагается, что исследуемый объект содержит ДНК двух или более индивидуумов.
Общий принцип расчетов следует из классического метода математической статистики
и был указан в NRC II: вероятность Р случайного совпадения
признаков, выявленных в изучаемом объекте и генотипе интересующего следствие
лица, равна сумме вероятностей встречаемости всех генотипов, сочетающихся с
анализируемым "смешанным" профилем. Базисный экспертный алгоритм был приведен
нами в указанных выше методических рекомендациях. Поскольку, однако, ситуации,
связанные с оценкой «смешанных» следов, реализуются в экспертизе в целом ряде
вариантов и имеют существенные различия в способе проведения расчетов, для этих
случаев была специально разработана методика.
Экспертные алгоритмы были составлены с учетом следующих моментов:
Наличие или отсутствие в объекте ДНК известного лица:
а) Объект априори содержит ДНК известного лица (например, ДНК потерпевшей в
случае обнаружения спермы в ее вагинальном содержимом).
б) Происхождение ДНК от конкретных лиц априори не известно (например, в случае
исследования следов крови на предметах, изъятых на месте происшествия).
В случае половых преступлений - наличие в объекте, кроме ДНК жертвы, ДНК
одного или нескольких лиц:
(а) Преступление не групповое. Объект содержит ДНК жертвы и преступника (слова
"преступник", "жертва" употреблены условно).
(б) Преступление групповое. Объект содержит ДНК жертвы и двух или более
преступников.
Не исключена возможность выявления неполной характеристики объекта.
Особенности расчета в зависимости от экспертной модели. Для различных
экспертных моделей разработаны алгоритмы вероятностных расчетов.
а) Модель "Объект содержит ДНК преступника и жертвы".
В этой модели априори возможны следующие три гипотезы:
А1 = {профиль ДНК Х обусловлен генотипом преступника};
А2= {профиль ДНК Х обусловлен генотипами преступника и жертвы};
A3 = {профиль ДНК Х обусловлен генотипом жертвы}.
Выводы о том, какая из этих гипотез справедлива, теория вероятностей сделать
не позволяет. Этот вопрос решается на основании данных, имеющихся по экспертизе.
Во многих случаях эксперт располагает данными, дающими ему основания предпочесть
одну из гипотез двум другим или, по крайней мере, какую-либо из них исключить.
Если же обстоятельства дела и данные, полученные в ходе исследования, не дают
возможности выбрать какую-либо из гипотез А1, А2, А3,
вычисляют каждую из вероятностей
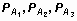
 и
затем в качестве окончательной оценки вероятности берут максимальную из них. Так
же поступают и при оценке двух гипотез, если исключена третья. Технология выбора
гипотез и проведения расчетов описана в методических рекомендациях.
и
затем в качестве окончательной оценки вероятности берут максимальную из них. Так
же поступают и при оценке двух гипотез, если исключена третья. Технология выбора
гипотез и проведения расчетов описана в методических рекомендациях.
б) Модель "Объект содержит ДНК двух (или более) преступников и жертвы".
Эта модель относится к случаям групповых преступлений. В этом случае
особенности имеют как оценка сочетаемости аллельных профилей, так и
вероятностные расчеты. Эта модель вводит дополнительные гипотезы, относящиеся к
количеству участников преступления, которые рассматриваются совместно с
гипотезами А1, А2, А3.
При групповом характере преступления вопрос о возможности присутствия в
изучаемом профиле аллелей ДНК конкретного подозреваемого решается с учетом всех
обстоятельств дела, генотипа потерпевшей, сочетания аллельных характеристик
конкретных подозреваемых; принимаются также данные исследования других
генетических маркеров. В общем виде не исключаются лица с любыми генотипами,
включающими аллели, присутствующие в профиле ДНК "смешанного" объекта. Бывают,
однако, ситуации, когда возможность присутствия в объекте ДНК конкретного
индивидуума исключается, несмотря на то, что его генотип состоит из аллельных
вариантов, содержащихся в анализируемом профиле ДНК (примеры рассмотрены в
методических рекомендациях).
в) Модель "Допускается выявление неполной аллельной характеристики объекта".
В рамках этой модели дополнительно рассматриваются две гипотезы:
В1 = {выявлена полная аллельная характеристика};
В2= {выявлена неполная аллельная характеристика};
В совокупности с гипотезами А1, А2, А3
гипотезы В1 и В2 дают шесть
различных сочетаний: В1А1, В1А2,
В1А3, В2А1, В2А2,
В2А3. Выбор нужной из них осуществляется
экспертом на основании имеющихся данных.
г) Модель "Объект содержит смесь ДНК нескольких лиц и ни одно из этих лиц не
известно".
В этом случае не исключается ни один из генетических профилей, выявленных в
объекте. Соответствующая вероятность рассчитывается как квадрат суммы
вероятностей всех выявленных аллелей: (р1 + р2 + …)2.
д) Модели, относящиеся к исследованию различных локусов.
Решение вопроса о генетическом родстве. Наиболее частым видом экспертизы, при
которой решается этот вопрос, является экспертиза спорного отцовства. Как
правило, она назначается по гражданским делам. В экспертной практике также
встречаются случаи, когда необходимость определения отцовства (или материнства)
возникает в связи с уголовными преступлениями.
Для всех перечисленных выше исследований по установлению тождества и по
установлению родства разработаны комплексы алгоритмов вычислений, которые
изложены в методических рекомендациях МВД РФ [49,50].
Методика интерпретации результатов генетического
анализа при идентификационном исследовании останков
неопознанных лиц
В связи с некоторыми особенностями экспертиз, при которых проводится
идентификация останков неопознанных лиц, и их все возрастающей значимостью для
практики, для этого вида исследований методика будет описана отдельно. Она
предназначена для исследований, проведенных с помощью анализа ядерной ДНК. Много
общего с этими вычислениями могут иметь расчеты в случае некоторых гражданских
дел, при которых устанавливается возможность родства (например, связанных с
решением вопроса о наследстве).
Принцип исследования. Идентификационное генетическое исследование останков
неопознанных лиц основывается на сравнительном изучении генотипа погибшего
(неопознанного лица – Н) и пропавшего без вести лица (П). Если результаты
генетического анализа останков не согласуются с генотипом пропавшего без вести,
исключают возможность того, что исследованные объекты являются останками данного
лица; если согласуются, то оценивают вероятность случайного совпадения
выявленных генетических признаков.
Способы установления генотипа пропавшего без вести (П). Для
установления генотипа лица, пропавшего без вести, существуют две возможности.
Одной из них является исследование образцов кровных родственников П,
на основании которых можно получить информацию о генотипе П.
Необходимо определить множество (А) допустимых для П
генотипов, то есть таких генотипов, которые согласуются с генотипами его
родственников. Если генотип, выявленный при исследовании останков неопознанного
лица Н, не входит в множество А, то они не могут
являться останками П. Если генотип Н входит в
множество А, то возможность того, что останки являются останками
П, не исключается.
Иным подходом может служить исследование в качестве сравнительных образцов
биологических объектов, в отношении которых достоверно известно, что они
произошли от П. (Решение вопроса о достоверности происхождения
этих объектов от пропавшего без вести является прерогативой следователя и
эксперт в этой части должен делать ссылку на постановление.) Такими объектами
могут быть следы крови пропавшего без вести на принадлежавших ему предметах
(следы носовых кровотечений, порезов, менструальной крови), а также некоторые
другие объекты, исследование которых возможно с помощью методов анализа ДНК, -
слюна на окурках, марках; следы иных выделений; волосы. В настоящее время
описано исследование также таких объектов, как слюна на зубных щетках; ногти;
гистологические препараты, которые могут остаться в медицинских учреждениях;
перхоть и т.д. [51-53]. При исследовании и интерпретации данных необходимо
учитывать характер объекта.
Принцип вероятностных расчетов. Искомой вероятностной величиной является
вероятность случайного совпадения признаков (Р). При использовании
в качестве сравнительных образцов биологических объектов, происшедших от П,
расчеты проводятся как для установления идентичности объектов. При исследовании
образцов родственников Р равна сумме вероятностей всех возможных
для П генотипов, т.е. всех генотипов во множестве А.
Вероятность Р не зависит от конкретного генотипа погибшего - важно
лишь, чтобы этот генотип входил в множество А. Если генотип
погибшего изменить, то ответ не изменится (при условии, что этот генотип
по-прежнему принадлежит множеству А). Предполагая, что все локусы
независимы, находят множество А и соответствующую вероятность
случайного совпадения для каждого локуса в отдельности. Общая вероятность
случайного совпадения есть произведение этих вероятностей для всех исследованных
локусов.
Поскольку проведение расчетов путем вычисления вероятности каждого из
генотипов является трудоемким процессом, целесообразно провести преобразования
для наиболее типичных моделей и вывести окончательные формулы расчета для
конкретных совокупностей генотипов. Разработанные алгоритмы значительно упрощают
вычисления.
В изученной литературе мы не встретили описания подобного подхода к
проведению вероятностных расчетов (обычно для этой цели используются
коэффициенты родства - [26]). Предложенная нами методика вычислений на основе
алгоритмов (Перепечина И.О., Гришечкин С.А., 2001 г.) позволяет оперировать с
конкретными, возможными для П, генотипами; она используется не только для
проведения вероятностных расчетов, но уже на этапе интерпретации результатов
генетического анализа. Заслуживает внимания то, что, хотя изучается возможность
генетического родства, получаемый результат, фактически, является результатом
решения вопроса о тождестве: устанавливается вероятность случайного совпадения
генотипа идентифицируемого лица с генотипом пропавшего без вести (который
определяется на основании генотипов родственников этого лица). Таким образом,
экспертный вывод может формулироваться в традиционном для экспертизы
установления тождества виде.
Данная методика предназначена для случаев, когда доступны образцы близких
родственников.
Информативность, обеспечиваемая в разных случаях исследования. Наибольшая
информативность исследования достигается в случае, когда удается определить
точный генотип П, а не его варианты. (В настоящей работе
принимается, что выявляемый генетический профиль соответствует генотипу
индивидуума по исследуемому локусу.) Это достижимо при исследовании произошедших
от П биологических объектов, в случае их пригодности для
типирования ДНК, а также в ряде случаев исследования генотипов родственников,
например: его обоих родителей; двух и более детей; одного из родителей (или
обоих родителей) и хотя бы одного ребенка; одного из родителей (или обоих
родителей), ребенка и жены (мужа). Это не значит, что исследование перечисленных
сочетаний позволяет установить единственно возможный генотип П во
всех случаях (при определенных конкретных сочетаниях генотипов указанных
родственников можно установить лишь множество возможных генотипов), однако есть
и такие сочетания, при которых устанавливается точный генотип П. В
то же время, при исследовании, например, образцов: только одного из родителей;
только одного ребенка; одного ребенка и жены (мужа); братьев или сестер -
определить точный генотип П нельзя ни при каких сочетаниях
генотипов. В этих случаях устанавливаются лишь варианты генотипа П
и информативность такого исследования ниже (соответствующая вероятность
случайного совпадения больше). Информативность генотипов различных родственников
П для установления его генотипа охарактеризована в таблице 6.
Таблица 6
Информативность генотипов различных родственников П, а также их сочетаний для
установления генотипа П
|
Родственники, генотипы которых известны |
Возможность установления точного генотипа П |
Возможность установления вариантов генотипа П |
|
Мать + отец |
+ |
+ |
|
Мать (отец) |
- |
+ |
|
Один ребенок |
- |
+ |
|
Двое и более детей |
+ |
+ |
|
Мать (отец) + ребенок |
+ |
+ |
|
Ребенок + жена (муж) |
- |
+ |
|
Двое и более детей + жена (муж) |
+ |
+ |
|
мать (отец) + ребенок + жена (муж) |
+ |
+ |
|
Брат (сестра) |
- |
- |
|
двое и более братьев (сестер) |
- |
+ |
|
двое и более братьев (сестер) + мать (отец) |
+ |
+ |
Приведенные в предыдущей главе экспертизы наглядно демонстрируют относительно
высокие величины вероятностей случайного совпадения признаков, получаемые в
экспертизах установления родства. Так, в экспертизе № 1665, несмотря на
значительное число исследованных локусов (11), вероятность случайного совпадения
оказалась весьма высокой - 0,0092. Причиной этого, с одной стороны, явились
свойственные данному индивидууму частотные характеристики - выявленные при
исследовании большинства локусов аллели относились к числу часто встречающихся в
популяции. С другой стороны, это отразило характерные для экспертизы
установления родства более высокие, по сравнению с установлением тождества,
вероятности случайного совпадения, особенно когда отсутствует образец второго
предполагаемого родителя (как в данном случае). Информативность исследования в
таких идентификационных экспертизах может быть повышена за счет расширения
спектра исследуемых локусов, а также включения в анализ генотипов других
родственников, если таковые имеются и если их генотипы информативны для
интерпретации. В данной экспертизе, кроме образца матери пропавшей без вести,
был предоставлен только образец сестры, который не мог повысить информативность
исследования и в расчетах не участвовал.
Еще одной возможностью повышения информативности анализа, как было отмечено
нами выше, является использование в качестве сравнительных образцов объектов, в
отношении которых достоверно известно, что они произошли от пропавшего без вести
лица. В случае пригодности найденных объектов для типирования установление
идентичности обеспечит значительно более высокую информативность, чем
сопоставление с образцами родственников. Например, в указанной экспертизе, в
случае, если бы проводилось установление идентичности, вероятность случайного
совпадения составила бы 0,56. Это служит существенным потенциалом для
идентификации, поэтому эксперту целесообразно ориентировать следователя на поиск
таких объектов. Результаты их исследования могут служить дополнением к
результатам, полученным при исследовании образцов родственников, или
использоваться самостоятельно.
Техника вероятностных расчетов. Для упрощения вычислений проведены
преобразования для каждой типичной модели и выведена окончательная формула
расчета для конкретной совокупности генотипов. Все варианты возможных генотипов
П, в условных обозначениях, можно свести к следующим:
а) (1,1). Р= р21
б) (1,2). Р= 2р1р2
в) (1, любой аллель). Р равна сумме вероятностей всех генотипов
локуса, включающих в себя аллель 1:
Р=Р(1,1) + Р(1,2) + Р(1,3) + ... + Р(1,n)
= р21 + 2р1р2 + 2р1р3 +
... + 2р1рn = р1(2-р1),
где n - число всех аллелей локуса.
г) (1 или 2, любой). Р равна сумме вероятностей генотипов,
содержащих аллель 1 и генотипов, содержащих аллель 2:
Р=P(1,1) + Р(1,2) + Р(1,3) + ... + Р(1,n)
+ P(2,n) + P(2,3) + ... + P(2,n) = p12
+ 2p1p2 + 2p1p3 + ... + 2p1pn
+ p22 + 2p2p1 + 2p2p3 +
2p2pn = (p1 + p2)(2 - p1
- p2).
д) (1, любой аллель), (2,3). Р равна сумме вероятностей
генотипов, входящих в совокупность (1, любой аллель) и вероятности генотипа
(2,3), т.е. Р=p1(2-p1) + 2p2p3.
е) (1 или 2, 2 или 3). Р равна сумме вероятностей генотипов (1,3), (1,4),
(2,3) и (2,4):
Р=P(1,3) + P(1,4) + P(2,3) + P(2,4)
= 2р1р3 + 2р1р4 + 2р2р3
+ 2 р2р4= 2(p1p3 + p1p4
+ p2p3 + р2р4) = 2(p1 (p3
+ p4) + р2(р3 + р4) ) = (2(р1
+ р2р3 + р4).
Типовые формулы вероятностных расчетов обобщены в табл. 7.
Таблица 7
Типовые формулы расчета вероятности случайного совпадения признаков
|
Генотип П |
Р |
| (1,1) |
р12 |
| (1,2) |
2р1р2 |
| (1, любой аллель) |
р1(2-р1) |
| (1 или 2, любой аллель) |
(p1 + p2)(2 - p1 - p2) |
| (1, любой аллель), (2,3) |
р1(2-р1)+ 2p2p3 |
| (1 или 2, 3 или 4), т.е. (1,3), (1,4), (2,3), (2,4) |
2(р1 + р2)(р3+ р4) |
| (1, 2 или 3), т.е. (1,2), (1,3) |
2р1(р2 + р3) |
Алгоритмы определения генотипа П и проведения вероятностных расчетов
В приведенных ниже таблицах используются условные обозначения аллелей,
которые в конкретном экспертном случае изменяются на реальные аллельные
варианты. Обозначение генотипов является условным не связано с какой-либо
характеристикой аллеля. Основное в обозначениях - то, что разные цифры
соответствуют разным аллелям. Продемонстрируем суть вычислений на наиболее
элементарном примере.
Пусть в распоряжение эксперта предоставлены образцы матери и отца П, генотипы
которых, соответственно, (1,2) и (3,4) (т.е. и мать, и отец гетерозиготны и не
имеют общих аллелей). Генотипы людей, которые теоретически могут быть детьми
данных родителей, схематически имеют вид (i,j), где i
- это 1 или 2 и j - это 3 или 4. Таким образом, множество А имеет
вид: А={ (1 или 2; 3 или 4)} , то есть {(1.3),(1,4),(2,3),(2,4)}.
Вероятности аллелей 1, 2, 3, 4 соответственно равны p1, p2,
p3, p4. Вероятность случайного совпадения P
равна (обозначение P[ ] используется для вероятности одного или
нескольких генотипов):
Р=P[А]=P[(1;3)+(1;4)+(2;3)+(2;4)]=P[(1;3)]+P[(1;4)]+P[(2;3)] + P[(2;4)]=
2(p1p3 + p1p4 + p2p3
+ p2p4) = 2(p1 + p2) (p3+p4).
Данному случаю соответствует следующий алгоритм.
Таблица 8
Возможные генотипы П и вероятностные расчеты в случае, если известны генотипы
обоих родителей П
|
Генотип матери (отца) П |
Генотип отца (матери) П |
Возможные генотипы П |
Вероятность Р |
| (1,1) |
(1,1) |
(1,1) |
Р21 |
| (1,1) |
(2,2) |
(1,2) |
2р1р2 |
| (1,2) |
(2,2) |
(1,2), (2,2) |
2р1р2 + р21 |
| (1,2) |
(1,2) |
(1,2), (1,1), (2,2) |
(р1+р2)2 |
| (1,2) |
(3,3) |
(1,3), (2,3) |
2р3(р1+р2) |
| (1,2) |
(3,4) |
(1,3), (1,4), (2,3), (2,4) |
2(р1 + р2)(р3+ р4) |
При исследовании генотипов обоих родителей (табл. 8) число возможных
вариантов генотипа П - не более 4. Максимальное число вариантов (4) имеет место
в случае, когда генотипы родителей гетерозиготны и не имеют общих аллелей, -
(1,2) и (3,4). Если оба родителя имеют гомозиготные генотипы, то генотип П
определяется точно: (1.1) при сочетаниях генотипов родителей (1,1) и (1,1) или
(1,2) при сочетаниях генотипов родителей (1,1) и (2,2).
Возможные генотипы П и вероятностные расчеты в случае, если известен генотип
одного из родителей П
Если известен генотип только одного из родителей, то информативность
исследования меньше, поскольку число возможных вариантов генотипа интересующего
лица больше. При гомозиготном генотипе родителя число возможных вариантов
исследуемого генотипа равно числу аллелей в локусе, при гетерозиготном генотипе
- удвоенному числу аллелей минус 1 (табл. 9). Точный генотип П в этой ситуации
не устанавливается.
Таблица 9
|
Генотип матери (отца) П |
Возможные генотипы П |
Вероятность Р |
| (1,2) |
(1 или 2, любой аллель) |
(p1 + p2)(2 – p1 - p2) |
| (1,1) |
(1, любой аллель) |
р1(2-р1) |
Возможные генотипы П и вероятностные расчеты в случае, если известны генотипы
родителей П и его ребенка
Введение в анализ дополнительных образцов может повысить информативность
исследования. В таблице 10 приведен алгоритм расчетов, когда в распоряжение
эксперта предоставлен, кроме образцов родителей П, образец его ребенка.
Рассмотрены те сочетания генотипов родителей, которые сами по себе (без
включения в анализ генотипа ребенка) не позволяют точно установить генотип П, и
информативность исследования целесообразно повысить. Жирный шрифт использован в
тех случаях, когда введение в исследование образца ребенка позволило сократить
число возможных для П генотипов, а следовательно, повысить информативность
исследования.
Возможные генотипы П и вероятностные расчеты в случае, если известны
генотипы одного из родителей П и его ребенка
Исследование генотипов одного из родителей и одного ребенка позволяет
установить точный генотип П только в случае, если оба генотипа гомозиготны и
различаются между собой. В других случаях устанавливаются варианты генотипов П.
Возможные генотипы П и вероятностные расчеты в случае, если известны
генотипы детей П
По информативности генотип ребенка П равен генотипу родителя П. Если
исследуются генотипы нескольких детей, информативность исследования может быть
еще более высокой. Так, если ребенок имеет гетерозиготный генотип (1,2), то
число возможных вариантов генотипа его отца П составляет удвоенное число аллелей
локуса минус 1. Если дополнительно исследуется генотип еще одного ребенка, то,
например, при генотипе (3,4) число возможных вариантов сокращается до четырех -
(1,3), (1,4), (2,3), (2,4).
Уже при анализе генотипов двух детей возможно точное установление генотипа П.
Если, например, генотип ребенка (1,1), то генотип его отца (П) может быть любым,
содержащим аллель 1, - (1,1), (1,2) и т.д. Однако если второй ребенок имеет
генотип (2,2), то генотип П определяется точно - (1,2). Понятно, что возрастание
информативности при увеличении числа генотипов детей наблюдается не во всех
случаях и зависит от конкретных сочетаний генетических признаков.
В таблице 12 приведен анализ генотипов П при различающихся генотипах его
одного, двух и трех детей, а также расчет вероятности. Случаи, когда генотипы
детей совпадают, не рассматриваются, поскольку не вносят отличий в
интерпретацию. Если имеется большее количество детей, чем 3, и генотипы их
различаются, выбирают из имеющейся совокупности 3 генотипа соответственно
указанным в таблице сочетаниям и устанавливают для них возможные генотипы П.
После этого анализируют, как согласуется генотип каждого последующего ребенка с
уже установленной совокупностью возможных генотипов П.
Таблица 10
|
Генотип матери (отца) П |
Генотип отца (матери) П |
Генотип ребенка П |
Возможные
генотипы П |
Вероятность Р |
| (1,1) |
(1,2) |
(1, любой аллель) |
(1,1), (1,2) |
р1(р1 + 2р2) |
| (1,1) |
(1,2) |
(2, любой аллель), кроме (1,2) |
(1,2) |
2р1р2 |
| (1,2) |
(1,2) |
(1, любой аллель), кроме (1,2) |
(1,1),(1,2) |
р1(р1 + 2р2) |
| (1,2) |
(1,2) |
(2, любой аллель), кроме (1,2) |
(1,2), (2,2) |
2р2(р1 + р3) |
| (1,2) |
(1,2) |
(1,2) |
(1,1), (1,2), (2,2) |
(р1+р2)2 |
| (1,2) |
(3,3) |
(1, любой аллель), кроме (1,2) и (1,3) |
(1,3) |
2р1р3 |
| (1,2) |
(3,3) |
(2, любой аллель), кроме (1,2) и (2,3) |
(2,3) |
2р2р3 |
| (1,2) |
(3,3) |
(3, любой аллель), кроме (1,3) |
(2,3) |
2р2р3 |
| (1,2) |
(3,3) |
(1,2),(1,3) или (2,3) |
(1,3), (2,3) |
2р3(р1 + р2) |
| (1,2) |
(3,4) |
(1, любой аллель), кроме (1,2),(1,3) и (1,4) |
(1,3),(1,4) |
2р1(р3 + р4) |
| (1,2) |
(3,4) |
(2, любой аллель), кроме (1,2),(2,3) и (2,4) |
(2,3),(2,4) |
2р2(р3 + р4) |
| (1,2) |
(3,4) |
(3, любой аллель), кроме (1,3),(2,3) и (3,4) |
(1,3),(2,3) |
2р3(р1 + р2) |
| (1,2) |
(3,4) |
(4, любой аллель), кроме (1,4),(2,4) и (3,4) |
(1,4),(2,4) |
2р4(р1 + р2) |
| (1,2) |
(3,4) |
(1,2) или (3,4) |
(1,3), (1,4), (2,3),(2,4) |
2(р1 + р2)(р3+ р4) |
| (1,2) |
(3,4) |
(1,3) |
(1,3), (1,4), (2,3) |
2(р1р3+р1р4+р2р3) |
| (1,2) |
(3,4) |
(1,4) |
(1,3),(1,4),(2,4) |
2(р1р3+р1р4+р2р4) |
| (1,2) |
(3,4) |
(2,3) |
(1,3),(2,3),(2,4) |
2(р1р3+р2р3+р2р4) |
| (1,2) |
(3,4) |
(2,4) |
(1,4),(2,3),(2,4) |
2(р1р4+р2р3+р2р4) |
Таблица 11
|
Генотип матери (отца) П |
Генотип ребенка П |
Возможные генотипы П |
Вероятность Р |
| (1,1) |
(1,1) |
(1, любой аллель) |
р1(2-р1) |
| (1,1) |
(1,2) |
(1, любой аллель) |
р1(2-р1) |
| (1,1) |
(2,2) |
(1,2) |
2р1р2 |
| (1,1) |
(2,3) |
(1,2),(1,3) |
2р1(р2+р3) |
| (1,2) |
(1,1) |
(1, любой аллель) |
р1(2-р1) |
| (1,2) |
(1,2) |
(1 или 2, любой аллель) |
(р1+р2)(2-р1-р2) |
| (1,2) |
(1,3) |
(1, любой аллель), (2,3) |
р1(2-р1)+2р2р3 |
| (1,2) |
(3,3) |
(1,3),(2,3) |
2р3(р1+р2) |
| (1,2) |
(3,4) |
(1,3),(1,4),(2,3), (2,4) |
2(р1+р2) (р3+р4) |
Таблица 12
|
Генотип ребенка 1 |
Генотип ребенка 2 |
Генотип ребенка 3 |
Возможные генотипы П |
Вероятность Р |
| (1,1) |
- |
- |
(1, любой аллель) |
р1(2-р1) |
| (1,2) |
- |
- |
(1 или 2, любой аллель) |
(р1+р2) (2-р1-р2) |
| (1,1) |
(1,2) |
- |
(1, любой аллель) |
р1(2-р1) |
| (1,1) |
(2,2) |
- |
(1,2) |
2р1р2 |
| (1,2) |
(1,3) |
- |
(1,любой аллель), (2,3) |
р1(2-р1) +2р2р3 |
| (1,2) |
(3,3) |
- |
(1,3),(2,3) |
2р3(р1+р2) |
| (1,2) |
(3,4) |
- |
(1,3),(1,4),(2,3),(2,4) |
(р1+р2)(р3+р4) |
| (1,1) |
(1,2) |
(1,3) |
(1,2),(1,3) |
2р1(р2+р3) |
| (1,1) |
(1,2) |
(2,2) |
(1,2) |
2р1р2 |
| (1,2) |
(2,2) |
(1,3) |
(1,2),(2,3) |
2р2(р1+р3) |
| (1,2) |
(1,3) |
(1,4) |
(1,2),(1,3),(1,4) |
2р1(р2+р3+р4) |
| (1,2) |
(1,3) |
(2,3) |
(1,2),(1,3),(2,3) |
2(р1р2+р1р2+р2р3) |
| (1,2) |
(1,3) |
(3,3) |
(2,3)(1,3) |
2р3(р1+р2) |
| (1,2) |
(3,4) |
(1,4) |
(1,3),(2,4) |
2(р1р3+р2р4) |
Возможные генотипы П и вероятностные расчеты в случае, если известны
генотипы ребенка и жены (мужа) П
Информативность анализа генотипов детей П в ряде случаев можно повысить, если
рассматривать также генотип второго из их родителей, т.е. жены (мужа) П.
Например, генотип ребенка П - (1,2). Из этого следует, что генотип П - (1 или 2,
любой аллель). Если известен также генотип жены (мужа) П - например (2,2), то
ясно, что аллель 2 ребенок получил от нее, а аллель 1 - от П. Это позволяет
сократить число возможных для П вариантов генотипов и рассматривать только те из
них, которые содержат аллель 1 (схема 1).
|
ребенок П (1,2)
¯
П: (1 или 2, любой аллель)
¯
+ жена (муж) П (2,2)
П: (1, любой аллель) |
Схема 1. Повышение информативности исследования при последовательном
включении в анализ генотипов ребенка и жены (мужа) П.
Таблица 13
|
Генотип ребенка П |
Генотип жены (мужа) П |
Возможные генотипы П |
Вероятность Р |
| (1,1) |
(1, любой аллель) |
(1, любой аллель) |
р1(2-р1) |
| (1,2) |
(1, любой аллель), кроме (1,2) |
(2, любой аллель) |
р2(2-р2) |
| (1,2) |
(2, любой аллель), кроме (1,2) |
(1, любой аллель) |
р1(2-р1) |
| (1,2) |
(1,2) |
(1 или 2, любой аллель) |
(р1+р2)(2-р1-р2) |
Возможные генотипы П и вероятностные расчеты в случае, если известны
генотипы двух детей и жены (мужа) П
Как видно из предыдущей таблицы, дополнение исследования генотипа одного
ребенка П изучением генотипа жены (мужа) П не позволяет устанавливать точный
генотип П. Это, однако, возможно, когда в исследовании участвуют генотипы двух
(или более) детей П. Например (см. схему 2), при генотипах детей (1,2) и (3,4)
возможны 4 варианта генотипа П - (1,3), (1,4), (2,3) и (2,4). Однако, если
дополнительно к этому исследовать генотип жены (мужа) П, то, независимо от
сочетаний его аллелей, генотип П всегда будет установлен точно (схема 2).
Возможные генотипы П и вероятностные расчеты в
случае, если известны генотипы одного из родителей,
ребенка и жены (мужа) П
В предыдущих пунктах была показана целесообразность исследования сочетаний
генотипов родителей и детей П, детей и жены (мужа) П. В некоторых случаях
информативность анализа может быть еще более повышена, если исследовать
сочетание генотипов родителей, детей и жены (мужа) П. На схеме 3 показано, что
даже в случае, если известны генотипы обоих родителей, такое комплексное
исследование может оказаться целесообразным.
Еще более информативным является такое исследование в случае, когда известен
генотип только одного из родителей. Интерпретация результатов в случае, если
известны генотипы одного из родителей, ребенка и жены (мужа) П, представлены в
табл. 15.
Таблица 14
|
Генотип ребенка 1 |
Генотип ребенка 2 |
Генотип жены (мужа) П |
Возможные генотипы П |
Вероятность Р |
| (1,1) |
(1,2) |
(1, любой аллель), кроме (1,2) |
(1,2) |
2р1р2 |
| (1,1) |
(1,2) |
(1,2) |
(1, любой аллель) |
р1(2-р1) |
| (1,1) |
(2,2) |
(1,2) |
(1,2) |
2р1р2 |
| (1,2) |
(1,3) |
(1, любой), кроме (1,2) и (1,3) |
(2,3) |
2р2р3 |
| (1,2) |
(1,3) |
(1,2) |
(1,3),(2,3) |
2р3(р1+р2) |
| (1,2) |
(1,3) |
(1,3) |
(1,2),(2,3) |
2р2(р1+р3) |
| (1,2) |
(1,3) |
(2,3) |
(1, любой аллель) |
р1(2-р1) |
| (1,2) |
(3,4) |
(1,3) |
(2,4) |
2р2р4 |
| (1,2) |
(3,4) |
(1,4) |
(2,3) |
2р2р3 |
| (1,2) |
(3,4) |
(2,3) |
(1,4) |
2р1р4 |
| (1,2) |
(3,4) |
(2,4) |
(1,3) |
2р1р3 |
|
1-й ребенок П (1,2) + 2-й ребенок П (3,4)
¯
П: (1,3), (1,4), (2,3), (2,4)
¯
+жена (муж) П: (1,3)
П: (2,4) |
Схема 2. Пример интерпретации результатов в случае исследования генотипов
двух детей и жены (мужа) П
|
Родители П: (1,2) х (3,4)
¯
П: (1,3), (1,4), (2,3), (2,4)
¯
+ ребенок П (1,3)
П: (1,3), (2, 3),(1,4)
¯
+ жена (муж) П (1.1)
П: (1,3),(2,3) |
Схема 3. Возрастание информативности исследования при последовательном
включении в анализ генотипов родителей, ребенка и жены (мужа) П
Возможные генотипы П и вероятностные расчеты в случае, если известны
генотипы двух братьев (сестер), а также двух братьев (сестер) и одного из
родителей П
Генотипы братьев и сестер могут как содержать общие аллели, так и не
содержать их, поэтому для конкретизации генотипа П исследование генотипов его
братьев и сестер использовано быть не может. Вместе с тем, изучение генотипов
родных братьев и сестер П может представлять интерес с точки зрения установления
генотипов родителей, что, в свою очередь, будет использовано для определения
генотипа П.
С точки зрения возможности установления генотипа П, генотип одного брата
(сестры) П, в отсутствие генотипов других родственников, не информативен. Не
информативен он и в том случае, когда известен генотип лишь одного из родителей
П. Это показывает следующий пример (Схема 4). Пусть известен генотип одного из
родителей - (1,2). Тогда генотип П - (1 или 2, любой аллель). Если у П есть
родной брат, генотип которого (1,1), то становится известно, что генотип второго
родителя - (1, любой аллель). Это, однако, ничего не дает для установления
генотипа П, т.к. у пары (1,2) х (1, любой аллель) дети имеют генотипы (1 или 2,
любой аллель). Но этот генотип был уже выведен для П ранее, до рассмотрения
генотипа брата, то есть т.е. включение его в анализ не информативно. Остальные
подобные ситуации аналогичны.
Иная ситуация может иметь место, если известны генотипы двух и более родных
братьев или сестер П. Рассмотрим следующий пример. Пусть известен генотип отца П
- (1,1). Из этого следует, что генотип П - (1, любой аллель). Если известны
также генотипы двух родных братьев П - (1,2) и (1,3), то выясняется генотип их
матери - (2,3). Сочетание генотипов родителей (1,1) х (2,3) дает только два
возможных варианта генотипов П - (1,2) и (1,3). Таким образом, после включения в
анализ генотипов братьев генотип П уточняется - (1,2) или (1,3).
Таблица 15
|
Генотип отца (матери) П |
Генотип ребенка П |
Генотип жены (мужа) П |
Возможные генотипы П |
Вероятность Р |
| (1,1) |
(1,1) |
(1, любой аллель) |
(1, любой аллель) |
р1(2-р1) |
| (1,1) |
(1,2) |
(1, любой аллель), кроме (1,2) |
(1,2) |
2р1р2 |
| (1,1) |
(1,2) |
(2, любой аллель) |
(1, любой аллель) |
р1(2-р1) |
| (1,1) |
(2,2) |
(2, любой аллель) |
(1,2) |
2р1р2 |
| (1,1) |
(2,3) |
(2, любой аллель), кроме (2,3) |
(1,3) |
2р1р3 |
| (1,1) |
(2,3) |
(3, любой аллель), кроме (2,3) |
(1,2) |
2р1р2 |
| (1,1) |
(2,3) |
(2,3) |
(1,2),(1,3) |
2р1(р2+р3) |
| (1,2) |
(1,1) |
(1, любой аллель) |
(1, любой аллель) |
р1(2-р1) |
| (1,2) |
(1,2) |
(1, любой аллель), кроме (1,2) |
(2, любой аллель) |
р2(2-р2) |
| (1,2) |
(1,2) |
(1,2) |
(1 или 2, любой аллель) |
(р1+р2)(2-р1-р2) |
| (1,2) |
(1,2) |
(2, любой аллель), кроме (1,2) |
(1, любой аллель) |
р1(2-р1) |
| (1,2) |
(1,3) |
(1, любой аллель) |
(1,3),(2,3) |
2р3(р1+р2) |
| (1,2) |
(1,3) |
(3, любой аллель), кроме (1,3) |
(1, любой аллель) |
р1(2-р1) |
| (1,2) |
(1,3) |
(1,3) |
(1, любой аллель),(2,3) |
р1(2-р1)+ 2р2р3 |
| (1,2) |
(3,3) |
(3, любой аллель) |
(1,3), (2,3) |
2р3(р1+р2) |
| (1,2) |
(3,4) |
(3, любой аллель), кроме (3,4) |
(1,4),(2,4) |
2р4(р1+р3) |
Таблица 16
|
Генотип брата 1 (сестры) П |
Генотип брата 2 (сестры) П |
Генотип отца (матери) П |
Возможные генотипы П |
Вероятность Р |
| (1,1) |
(1,2) |
- |
(1 или 2, любой аллель) |
(р1+р2)(2-р1-р2) |
| (1,1) |
(1,2) |
(1,1) |
(1,1),(1,2) |
р12+2р1р2 |
| (1,1) |
(1,2) |
(1,2) |
(1 или 2, любой аллель) |
(р1+р2)(2-р1-р2) |
| (1,1) |
(1,2) |
(1,3) |
(1,1),(1,2),(1,3),(2,3) |
р12+2(р1р2+р1р3+р2р3) |
| (1,1) |
(2,3) |
- |
(1,1),(1,2),(1,3),(2,3) |
р12+2(р1р2+р1р3+р2р3) |
| (1,1) |
(2,3) |
(1,2) или (1,3) |
(1,1),(1,2),(1,3),(2,3) |
р12+2(р1р2+р1р3+р2р3) |
| (1,2) |
(3,4) |
- |
(1,2),(1,3),(1,4),(2,3),(2,4),(3,4) |
2(р1р2+р1р3+р1р4+р2р3+р2р4+р3р4) |
| (1,2) |
(3,4) |
(2,4) или (1,3) |
(1,2),(1,4),(2,3),(3,4) |
2(р1+р3)(р2+р4) |
| (1,2) |
(3,4) |
(1,4) или (2,3) |
(1,2),(1,3),(2,4),(3,4) |
2(р1+р4)(р2+р3) |
| (1,1) |
(2,2) |
- |
(1,1),(1,2),(2,2) |
(р1+р2)2 |
| (1,1) |
(2,2) |
(1,2) |
(1,1),(1,2),(2,2) |
(р1+р2)2 |
|
Мать (отец) П: (1,2 )
¯
П: (1 или 2, любой аллель)
¯
+ брат П (1,1)
Родители П: (1,2) х (1, любой аллель)
¯
П: (1 или 2, любой аллель) |
Схема 4. Включение в генетический анализ генотипа родного брата (сестры) П не
повышает информативности исследования родительского генотипа для установления
генотипа П.
Информативными генотипы двух и более братьев (сестер) П могут быть и в
отсутствие известного родительского генотипа. Это видно из следующего примера.
Пусть известны генотипы двух родных братьев П - (1,2) и (1,1). Генотипы обоих их
родителей обязательно должны содержать аллель 1, причем генотип одного из
родителей (1,2), а другого - (1, любой аллель). Из этого следует, что генотип П
- (1 или 2, любой аллель).
Еще более может позволить уточнить генотип П введение в анализ генотипа
третьего брата П. Если этот генотип - (1,3), тогда генотипы родителей становятся
определенными - (1,2) и (1,3). Следовательно, П имеет один из следующих
вариантов генотипа - (1,1), (1,2), (1,3).
Таким образом, в отношении информативности генотипов братьев (сестер) П для
установления его генотипа можно сделать следующие выводы. Поскольку генотипы
братьев (сестер) П изучаются с целью определения генотипов родителей П, когда
есть возможность непосредственно определить генотипы обоих родителей П путем
исследования их образцов, включать в анализ генотипы братьев или сестер П не
имеет смысла. Если же известен генотип только одного из родителей П, либо
генотипы родителей не известны совсем, то генотипы братьев (сестер) П могут
представлять интерес. Для этого, однако, необходимы образцы не менее двух
братьев (сестер).
Интерпретация результатов исследования в случае, если известны генотипы двух
братьев (сестер), а также двух братьев и одного из родителей П, показана в табл.
16. Рекомендуемые сравнительные образцы. Поскольку сочетания генотипов заранее
не известны, для обеспечения максимальной информативности исследования
рекомендуется, по возможности, запрашивать все следующие образцы: обоих
родителей, детей и жены (мужа) П. Генотипы братьев (сестер) П изучаются с целью
определения генотипов родителей П, поэтому при наличии образцов обоих родителей
П исследование образцов братьев или сестер П информативности не повышает; их
целесообразно запрашивать, если не могут быть предоставлены образцы родителей
(или одного из них). Представление типовых алгоритмов для случаев исследования
образцов более дальних родственников нецелесообразно, поскольку они обычно
громоздки. Такой анализ требует специального рассмотрения в каждом конкретном
случае. Общий принцип его следующий: исследование генотипов более дальних
родственников П проводят для выведения генотипов более близких его родственников
и, в конечном счете, для определения множества А (вариантов генотипов П).
Таблица 16
|
Генотип брата 1 (сестры) П |
Генотип брата 2 (сестры) П |
Генотип отца (матери) П |
Возможные генотипы П |
Вероятность Р |
| (1,1) |
(1,2) |
- |
(1 или 2, любой аллель) |
(р1+р2)(2-р1-р2) |
| (1,1) |
(1,2) |
(1,1) |
(1,1), (1,2) |
р12+2р1р2 |
| (1,1) |
(1,2) |
(1,2) |
(1 или 2, любой аллель) |
(р1+р2)(2-р1-р2) |
| (1,1) |
(1,2) |
(1,3) |
(1,1), (1,2), (1,3),
(2,3) |
р12+2(р1р2+р1р3+р2р3) |
| (1,1) |
(2,3) |
- |
(1,1), (1,2), (1,3),
(2,3) |
р12+2(р1р2+р1р3+р2р3) |
| (1,1) |
(2,3) |
(1,2) или (1,3) |
(1,1), (1,2), (1,3),
(2,3) |
р12+2(р1р2+р1р3+р2р3) |
| (1,2) |
(3,4) |
- |
(1,2), (1,3), (1,4),
(2,3), (2,4),
(3,4) |
2(р1р2+р1р3+р1р4+р2р3+р2р4+р3р4) |
| (1,2) |
(3,4) |
(2,4) или (1,3) |
(1,2), (1,4),
(2,3),(3,4) |
2(р1+р3)(р2+р4) |
| (1,2) |
(3,4) |
(1,4) или (2,3) |
(1,2), (1,3), (2,4),
(3,4) |
2(р1+р4)(р2+р3) |
| (1,1) |
(2,2) |
- |
(1,1), (1,2), (2,2) |
(р1+р2)2 |
| (1,1) |
(2,2) |
(1,2) |
(1,1), (1,2), (2,2) |
(р1+р2)2 |
Так, исследование генотипов бабушек (дедушек) проводят для установления
генотипов родителей П, генотипы внуков - для установления генотипов детей П и
т.д. При сложных вариантах родства используют другие подходы, в частности,
исследование митохондриальной ДНК.
Изложенную здесь методику исследования можно использовать не только для
идентификации останков неизвестных лиц, но также для других случаев, когда
необходимо установить возможность биологического родства и провести
соответствующий вероятностный анализ. В таких исследованиях в качестве П будет
выступать лицо, биологическое родство которого устанавливается.
2.4. Сравнительный анализ идентификационной значимости генетических
признаков на основе вычисления вероятности случайного совпадения (P) и отношения
правдоподобия (LR). Оценка классического (небайесовского) и байесовского методов
математической статистики применительно к ДНК-идентификации
Имеющиеся подходы к вероятностной интерпретации данных ДНК-анализа
основываются на классическом методе математической статистики, при котором
искомой величиной является вероятность случайного совпадения признаков (match
probability – МР, или Р ), или на байесовском методе, при котором рассчитывается
отношение правдоподобия (likelihood ratio - LR) [26]. Поскольку оба подхода к
вычислениям являются правомерными и рассматриваются в качестве альтернативных,
возникает вопрос о том, как соотносятся между собой величины Р и LR,
рассчитанные по одному и тому же экспертному случаю. В элементарном случае,
когда объект содержит ДНК только одного лица, LR связано с Р соотношением
LP=1/P и оба подхода, в сущности, эквивалентны. В других случаях,
например при анализе "смешанных" следов, могут быть иные зависимости.
В литературе нам не встретилось исследования, посвященного анализу того, как
реально соотносятся данные вероятностные величины. Поэтому мы рассмотрели
значения Р и LR, вычисленные применительно к различным вариантам исследования
объектов, содержащих ДНК двух и более индивидуумов, проследив тенденции их
изменения в зависимости от параметров модели и проанализировав соотношение этих
величин между собой.
Соотношение величин P и LR
Изучали зависимость Р и LR от: (а) числа индивидуумов, ДНК которых
присутствовала в объекте; (б) характера генетического профиля и сочетания
генотипов проходящих по делу лиц; (в) соотношения частот аллельных вариантов.
Вычисления проводили с использованием компьютерной программы "Grape". Результаты
исследования позволили проследить закономерности, присущие обоим методам
вычислений. В расчетах основывались на данных о частотном распределении
аллельных вариантов STR-локусов в европеоидной популяции (Promega Corporation,
1996). При выполнении этого исследования мы не ставили своей задачей подробное и
точное математическое описание выявленных закономерностей - нас интересовали
только тенденции, с тем, чтобы оценить, каково может быть их влияние на
интерпретацию результатов.
Зависимость Р и LR от числа участников
преступления
С целью изучения закономерностей распределения вероятностей, были прослежены
значения P и LR для случаев, когда объект содержит ДНК известного лица (жертвы),
а также еще одного или нескольких индивидуумов ("участников преступления").
Большое число участников преступления (до 8) было использовано для того, чтобы
проследить характер изменения рассчитываемых величин. В табл. 17 представлены
данные для одного из сочетаний аллельных профилей, которые могут служить
примером наблюдаемых зависимостей. Как при использовании Р, так и при
использовании LR, информативность исследования в случае одного участника всегда
выше, чем в случае нескольких участников.
Таблица 17
Зависимость Р и LR от числа участников преступления (локус F13A01)
|
Аллельный профиль объекта Х |
Генотип жертвы |
Генотип подозреваемого |
Количество участников преступления |
P |
LR |
| 3.2, 4 |
3.2, 3.2 |
4,4 или 3.2, 4 |
1 |
1:115.594 |
115.594 |
| - " - |
- " - |
Различные сочетания 4,4; 3.2,4 и 3.2,3.2 |
2 |
1:62.9882 |
79.4409 |
| - " - |
- " - |
- " - |
3 |
1:62.9882 |
69.5427 |
| - " - |
- " - |
- " - |
4 |
1:62.9882 |
65.8110 |
| - " - |
- " - |
- " - |
5 |
1:62.9882 |
64.2422 |
| - " - |
- " - |
- " - |
6 |
1:62.9882 |
63.5527 |
| - " - |
- " - |
- " - |
7 |
1:62.9882 |
63.2438 |
| - " - |
- " - |
- " - |
8 |
1:62.9882 |
63.1043 |
Примечание. Частоты аллелей 3.2 и 4 - соответственно, 0.084 и 0.041.
Таблица 18
Зависимость Р и LR от генотипов подозреваемых (локус ТРОХ). Вариации Р и LR в
зависимости от частот аллелей
|
Аллельный
профиль объекта Х |
Генотип жертвы |
Генотип подозреваемого |
Количество
участников |
P |
LR |
| 6, 8, 11, 12 |
11, 11 |
6, 8 |
1 |
- |
- |
| - " - |
- " - |
- " - |
2 |
1:1.5539 |
115.764 |
| - " - |
- " - |
- " - |
3 |
1:1.3808 |
81.8891 |
| - " - |
- " - |
- " - |
4 |
1:1.3808 |
64.9179 |
| - " - |
- " - |
- " - |
5 |
1:1.3808 |
53.8570 |
| 6, 8, 11, 12 |
11, 11 |
6, 12 |
1 |
- |
- |
| - " - |
- " - |
- " - |
2 |
1:1.5539 |
1164.8300 |
| - " - |
- " - |
- " - |
3 |
1:1.3808 |
492.2750 |
| - " - |
- " - |
- " - |
4 |
1:1.3808 |
276.473 |
| - " - |
- " - |
- " - |
5 |
1:1.3808 |
179.891 |
| 6, 8, 11, 12 |
11, 11 |
12, 12 |
1 |
- |
- |
| - " - |
- " - |
- " - |
2 |
1:1.5539 |
3.9688 |
| - " - |
- " - |
- " - |
3 |
1:1.3808 |
4.4531 |
| - " - |
- " - |
- " - |
4 |
1:1.3808 |
3.8570 |
| - " - |
- " - |
- " - |
5 |
1:1.3808 |
3.3522 |
| 6, 8, 11, 12 |
11, 11 |
6, 6 |
1 |
- |
- |
| - " - |
- " - |
- " - |
2 |
1:1.5539 |
73.4217 |
| - " - |
- " - |
- " - |
3 |
1:1.3808 |
77.8691 |
| - " - |
- " - |
- " - |
4 |
1:1.3808 |
64.4884 |
| - " - |
- " - |
- " - |
5 |
1:1.3808 |
53.8088 |
Примечание. Частоты аллелей 6, 8, 11 и 12 - соответственно, 0.002, 0.524,
0.285 и 0.038.
В каждой ситуационной модели (определенного генетического профиля объекта и
определенного сочетания генотипов жертвы и участников преступления) имеется не
более двух вариантов Р. Один из них (Р1) рассчитывается для минимального числа
участников преступления, при котором возможен данный профиль объекта, а другой
(Р2) - для любого другого числа участников. Величина Р1 всегда меньше Р2.
Величина LR значительно более дифференцирована: каждому числу участников
преступления соответствовует своя величина LR. Если расчет ведется для объекта,
содержащего, помимо ДНК жертвы, ДНК еще одного индивидуума, то LR, также как в
случае "изолированных" следов, равна 1/Р. Величина LR уменьшается с каждым новым
участником преступления, причем максимальное изменение наблюдается в начале
ряда.
Зависимость Р и LR от характера генетического профиля и сочетания генотипов
проходящих по делу лиц
В соответствии с принципом расчета Р, ее величина зависит только от характера
анализируемого генетического профиля и сочетания его с генотипом жертвы. От
генотипа конкретного подозреваемого величина Р не зависит, т.к. расчет ведется в
отношении всех неисключающихся генотипов, и важно только то, чтобы генотип
подозреваемого входил в это множество.
Вычисление LR проводится дифференцированно, с учетом генотипа конкретного
подозреваемого. В связи с этим, при исследовании объектов, содержащих ДНК двух и
более участников преступления, для подозреваемых с разными генотипами
идентификационная значимость выявленного профиля ДНК может быть как одинаковой
(см. табл. 17), так и различной (табл. 18). Это зависит от сочетания
анализируемого профиля и генотипов проходящих по делу лиц.
Зависимость от соотношения частот аллелей
Частоты аллелей существенно отражаются на полученных величинах. Чем больше
различие в частотах аллелей, используемых в расчетах, тем больше различия в
результатах вычислений для разных условий модели, а также для P и LR. Обратимся
снова к таблицам 1 и 2. Рассмотрим профиль (3.2, 4) локуса F13A01 (табл. 18).
Аллели 3.2 и 4 имеют умеренно отличающиеся частоты - 0.084 и 0.041, с
соотношением 0.084/0.041=2.05. Расчеты, проведенные для разных вариантов, не
выявляют больших различий ни между Р и LR, ни между различными сочетаниями
генотипов в пределах этой модели, ни между значениями, полученными для разного
числа участников; максимальное соотношение между ними - 1.84. Иная картина
наблюдается в случае значительных различий между частотами аллелей. Примером
этому могут служить модели, составленные на основе аллелей 6, 8, 11, 12 локуса
ТРОХ с частотами, соответственно, 0,002, 0,524, 0,285 и 0,038 (табл. 18).
Максимальное соотношение между этими частотами - 262; максимальное соотношение
между вероятностными величинами - 750.
Обсуждение вопросов применения байесовского и небайесовского методов
Отмеченные зависимости в отношении значений Р и LR можно обобщить следующим
образом.
В идентификационных исследованиях, связанных с установлением генетического
тождества, выбор способа расчета - Р или LR - для объектов, оцениваемых
экспертом как содержащие ДНК одного лица, либо как гетерогенные, в которых
содержится ДНК лица с известным генотипом (жертвы) и ДНК одного неизвестного
индивидуума, не отражается на результатах исследования, поскольку данные
величины эквивалентны. При другом числе неизвестных участников преступления (контрибьюторов)
выявляются различия. Таким образом, базируясь на одной и той же генетической
информации (выявленном профиле ДНК и частоте встречаемости составляющих его
аллелей), Р и LR в ряде случае неодинаково оценивают идентификационную
значимость этой информации в зависимости от характера генетических данных и
априорной информации, связанной с оценкой обстоятельств происшествия (число
участников преступления). Наиболее часто объекты, содержащие ДНК нескольких
неизвестных лиц, встречаются при групповых половых преступлениях, поэтому
различия между двумя подходами к вычислениям касаются, прежде всего, этой
категории преступлений. Учитывая, что объекты, исследуемые при половых
преступлениях, часто имеют непосредственную связь с событием преступления, и
результаты экспертизы имеют важное значение в системе доказательств по делу, а
также то, что групповые преступления предусматривают большие сроки наказания,
проблема выбора способа вычисления заслуживает особого внимания.
Различия в числе неизвестных участников преступления не затрагивают Р. Что
касается LR, то каждому числу участников преступления соответствует своя
величина LR. Поскольку дифференцировать количество участников по профилям ДНК,
как правило, не представляется возможным, экспертный вывод основывается на
сделанных экспертом допущениях. Это вносит в исследование элемент субъективизма
и при оценке экспертизы может служить формальной причиной для того, чтобы
поставить под сомнение правильность расчетов. В случае ошибки она максимальна в
начале ряда (т.е. при малом числе участников преступления – главным образом,
1-3), уменьшаясь с увеличением числа индивидуумов. Для того, чтобы преодолеть
эту проблему, при неизвестном числе контрибьюторов эксперту, на наш взгляд,
целесообразно прослеживать в расчетах некий разумный диапазон значений, учитывая
при итоговой оценке выявленный возможный разброс в величинах. Если эксперт не
видит оснований для рассмотрения возможности группового характера преступления,
либо проводит расчеты в соответствии с данными следствия об определенном числе
участников преступления, это должно быть оговорено в заключении.
Выше было показано, в ряде случаев расчет LR обеспечивает значительно более
весомые величины, чем это возможно при вычислении Р, что зависит от используемых
в расчетах различий в частотах аллелей. Это делает ДНК-анализ, в случае
использования LR, еще более мощным инструментом идентификации. Оценивая это как
положительный момент, нельзя, однако, упускать из виду, что это предъявляет еще
более высокие требования к достоверности данных, используемых на всех этапах
анализа, а именно:
1) достоверности данных, получаемых в ходе лабораторной части анализа;
2) корректности математических расчетов, зависящей, в свою очередь, от ряда
факторов: а) адекватности используемого математического аппарата, б)
правильности выполнения расчетов и в) полноты и достоверности используемых в
расчетах популяционных данных;
3) достоверности априорной информации, используемой при проведении расчетов (о
числе участников).
Если проблема, связанная с оценкой априорной информации (3), является общей
проблемой использования данного метода где бы то ни было, то первые два момента
нельзя рассматривать безотносительно к особенностям отечественной экспертной
практики, т.е. к условиям применения метода. Здесь, в свою очередь, необходимо
отметить следующее
В отечественной экспертной практике отсутствует система обеспечения и
контроля качества исследований в экспертных лабораториях, которая
регламентировала бы порядок выполнения исследований, контроль за деятельностью
лаборатории, позволяла бы выявлять общий уровень ошибок в лаборатории,
контролировать квалификацию экспертов и т.д. Этому вопросу в зарубежной практике
придается очень большое значение (соответствующие программы носят название
Quality Assurance Programme, Quality Control Programmes), однако у нас эта
проблема рассмотрена еще очень мало.
Расчеты при применении классического метода математической статистики
достаточно просты и могут быть выполнены даже без использования компьютерных
программ. Для расчетов LR необходим сложный математический аппарат; реально они
могут выполнены лишь с помощью специальных компьютерных программ, что
значительно затрудняет проверку результатов вычислений и представление их в
суде. Все это требует не только наличия соответствующих компьютерных программ по
всем разделам экспертизы (утвержденных к применению в нашей стране), но и
высокого уровня математической грамотности экспертов. Например, в Великобритании
производство экспертиз с использованием ДНК-анализа сосредоточено в одном
учреждении и все этапы, связанные с выполнением математической обработки
результатов экспертизы и защитой ее в суде, осуществляется ограниченным числом
высококвалифицированных профессионалов в области теории вероятностей и
математической статистики. И даже в этих условиях представление результатов
вычислений в суде часто вызывает сложности. В отличие от Великобритании,
российская практика не имеет подобного института. Экспертизы выполняются в
большом числе лабораторий, специалисты которых не имеют базового математического
образования и имеют лишь ограниченные представления о теории вероятностей и
методах математической статистики. Введению в экспертизу сложного
математического аппарата должна предшествовать подготовка кадров, обученных по
специально разработанным учебным программам математической интерпретации,
включающим данные методы вычислений, а также адекватного компьютерного
программного обеспечения по всем разделам экспертизы. Проблемой обеспечения
достаточной корректности расчетов (имеющей место и при расчете Р, но еще более
острой при использовании расчета LR) является также отсутствие в нашей стране и
надежных популяционных данных.
Последний момент, который бы мы хотели бы отметить обсуждая два данных
способа расчета, это характер формулировок экспертных выводов. Величине Р
соответствуют довольно абстрактные выводы, характеризующие редкость выявленных
признаков. В то же время, эти формулировки отличает то, что, если рассматривать
их с двух противоположных позиций - прокурора и адвоката, они абсолютно
нейтральны, поскольку сообщают только факты и не поддерживают ни одну из сторон.
Рассмотрим теперь пример формулировки, соответствующей LR (из заключения
британской экспертно-криминалистической службы): "Мы оцениваем, что результаты,
полученные при ДНК-анализе пятна крови, в 3300 раз более вероятны в случае, если
источником этой крови является подозреваемый, чем другой неродственный
индивидуум". Совершенно очевидно, что эта формулировка не нейтральна, несет
четко "обвинительный" характер, причем он обусловлен не сообщаемыми цифрами, а
словесным выражением LR. Например, утверждение, что полученные результаты в 10
раз более вероятны в случае, если источником данных следов крови является
подозреваемый, чем другой человек, также оказывает психологический эффект, хотя
соответствующая этому вероятность составляет всего 1:10.
Перечисленное выше касается моментов, относящихся к использованию LR как
такового. Рассмотрим теперь некоторые аспекты, касающиеся применения этой
величины в рамках байесовского подхода.
С байесовским методом связана весьма парадоксальная ситуация. Разработанный в
десятках публикаций, в которых описаны его достоинства, этот метод имеет,
однако, крайне ограниченное применение. Сам B. Weir, один из основных его
разработчиков применительно к ДНК-идентификации, отметил, что в практике
байесовский метод будет использоваться, видимо, еще очень нескоро [54]. В
сообщении, сделанном в 2000 году Консультативным Советом США по ДНК-анализу
[55], указано, что к байесовскому методу при рассмотрении уголовных дел в
американских судах не обращались, всерьез этот метод в судах не рассматривался.
В Европе, по данным опроса ENFSI, байесовский подход используется лишь в двух
европейских лабораториях из 19, участвовавших в опросе [56].
Причиной столь осторожного подхода к байесовскому методу является сложность
оценки данных, связанных с оценкой обстоятельств происшествия. Такие данные
участвуют не только в вычислении величины LR, но и определяют априорные
вероятности, формирующие, наряду с LR, окончательный результат анализа ДНК.
Не является случайным, что применительно к ДНК-идентификации байесовский
подход наибольшее применение получил в Великобритании. Это связано с системой
судебного уголовного процесса, сложившейся в этой стране. Байесовский метод
математической статистики применяется во всей системе оценки доказательств по
уголовному делу, что обусловливает закономерность его использования и для
анализа данных исследования ДНК. Генетические данные органично вписываются в
общий комплекс доказательств. Не располагая данными для оценки априорной
вероятности, эксперт рассчитывает и представляет в своем заключении лишь
величину LR, показывающую, во сколько раз возросла доказательственность данных
по делу после проведения ДНК-анализа. Априорные же вероятности вычисляются на
основе всех известных обстоятельств дела уже не экспертом, вне
ДНК-идентификации, равно как и апостериорные вероятности.
Такой логический путь применения байесовского подхода неосуществим, если в
судебной системе страны оценка всей совокупности данных на основе байесовского
метода не используется. Это делает невозможным расчет априорных вероятностей на
основании известных следствию обстоятельств дела, а следовательно, лишает
байесовский подход необходимого фактического базиса. В таких условиях
целесообразность и возможность полноценного применения этого метода
математической статистики в ДНК-идентификации должны оцениваться иначе. Именно
такая ситуация имеет место и в нашей стране.
Кто и как должен рассчитывать априорные вероятности в этом случае? Эксперт не
компетентен в оценке обстоятельств дела, поэтому естественно ожидать, что любая
выбранная им по его разумению величина априорной вероятности явится мишенью для
критики в суде и может поставить под удар всю экспертизу. Не имеет никакой
серьезной аргументации, в том числе, и «усреднение» априорной вероятности -
принятие в качестве ее величины 0,5, что означает априорное принятие экспертом
равной возможности происхождения объекта от данного лица или от какого-либо
иного индивидуума. Возражения против такого подхода в экспертизах по уголовным
делам были высказаны на совещании европейской рабочей группы по
судебно-медицинскому ДНК-анализу ENFSI (Мадрид, декабрь 1998 г.).
Стратегия дистанцирования эксперта от определения априорных вероятностей
доминирует не только в английской, но и в американской литературе. В NRC II
высказывается критическое отношение к представлению экспертом какой-либо
определенной величины априорной вероятности. В качестве варианта в этом
источнике обсуждается подход, когда экспертом представляется в заключении только
величина LR; априорные же вероятности даются судом присяжных, после чего
делается окончательный расчет. Еще одним вариантом, предлагаемым NRC II,
является проведение вероятностных расчетов на основе целой шкалы
предположительных значений априорных вероятностей, с тем, чтобы суд мог выбрать
из них наиболее соответствующую данному случаю.
Представляется, однако, что вопрос, не только в технологии выбора априорных
вероятностей, а в самой сути такого подхода. Определение априорных вероятностей
в условиях неочевидности не позволяет говорить о их точности, однако они
оказываются включенными в оценку генетических данных. Рассмотрение результатов
анализа ДНК с учетом других собранных по делу доказательств таит в себе
определенный риск утраты ДНК-идентификацией независимости от других данных,
истинность и ценность которых для данного дела суду заведомо не известны и могут
впоследствии пересматриваться. В отличие от этого, классический метод
математической статистики обеспечивает получение более объективной вероятностной
характеристики, "чистых фактов". В этом контексте обеспечиваемая им
независимость вероятностных расчетов по ДНК-идентификации от других
доказательств по делу может расцениваться и как независимость от тех ошибок, от
которых не застрахован любой уголовный и гражданский процесс.
Актуальность проблемы оценки априорных вероятностей снижается по мере
повышения информативности ДНК-анализа. При большом количестве исследуемых
локусов различия в расчетах, сделанных применительно к разным априорным
вероятностям, нивелируются и влияние их на конечный результат становится
неощутимым. В условиях высокой информативности, однако, исчезают и ограничения,
присущие классическому методу: при крайне низких значениях вероятности
случайного совпадения она становится самоценной величиной и может быть оценена
на основании критериев, для которых обстоятельства дела не имеют значения; в
этих условиях усложнение интерпретации использованием байесовского подхода
теряет смысл.
Вопрос о выборе базисного метода математической статистики для интерпретации
данных концептуален и имеет большое значение для практики. Какой из двух методов
математической статистики предпочтителен при использовании в экспертизах по
уголовным делам, остается пока предметом дискуссий. Каждый из них имеет как свои
достоинства, так и недостатки. Что касается байесовского метода, то в отличие от
достоинств, обстоятельно описанных в литературе, проблемы, связанные с его
использованием применительно к ДНК-идентификации, освещены мало. С целью дать
взвешенную и объективную оценку этому методу, мы попытались рассмотреть
различные стороны его применения в практике (в особенности – отечественной),
намеренно заострив внимание на проблемах. Независимо от научной стороны этого
метода (которая, как было показано, также нуждается в обсуждении), условия его
применения в отечественной практике таковы, что они не позволяют в настоящее
время, корректно его использовать.
Это явилось причиной того, что при разработке для экспертной службы системы
математической интерпретации мы сочли единственно правильным на данном этапе
представить ее на основе классического метода математической статистики.
Бесспорность математической стороны этого метода, объективный характер данных,
доступность математического аппарата лицам, осуществляющим применение метода и
его оценку в условиях, в которых реализуется экспертная и судебная практика в
России, – явились теми преимуществами, которые сделали его предпочтительным для
экспертной разработки.
Важным свойством байесовского подхода является то, что он, потенциально,
позволяет делать выводы, которые более точно и детально учитывают обстоятельства
дела. Это представляет значительный интерес для практики. Однако, как было нами
показано, условием грамотного и адекватного его применения является соблюдение
целого комплекса требований, которые должны быть обязательно учтены, прежде чем
этот метод будет рекомендован для внедрения в широкую экспертную практику. Кроме
того, необходимо также осмысление ряда иных его аспектов, о которых шла речь
выше.
Отметим, что ни один из обсуждаемых методов не отменяет другой и не должен
быть безальтернативным. Разработка различных аспектов
вероятностно-статистического анализа данных ДНК-идентификации должна
реализоваться на основе всестороннего использования возможностей теории
вероятностей и математической статистики, определения границ применения каждого
из подходов и предпочтительности их для тех или иных экспертных ситуаций. Это
возможно лишь в результате объективного рассмотрения всех важных сторон
применения этих методов для экспертных целей.
3. РАЗРАБОТКА КОНЦЕПЦИИ СОЗДАНИЯ В РОССИИ ФЕДЕРАЛЬНОЙ СИСТЕМЫ Д Н
К-РЕГИСТРАЦИИ (ГЕНЕТИЧЕСКИХ УЧЕТОВ)
Развитие технологии ДНК-анализа позволило значительно расширить его
возможности. В 1994 году перед отечественной экспертно-криминалистической
службой была поставлена задача формирования федеральной системы генетических
учетов. Эта задача была сформулирована в Федеральной программе Российской
Федерации по усилению борьбы с преступностью на 1994-1995 годы, утвержденной
Указом Президента России № 1016 от 24 мая 1994 года, и продолжена в
соответствующей Федеральной программе на 1996-1997 годы. Проблема была абсолютно
нова как для России, так и для других стран.
Прежде всего, была разработана соответствующая концепция.
3.1. Концепция создания в России федеральной системы ДНК-регистрации
Обоснование целесообразности создания в России
федеральной системы ДНК-регистрации
Создание системы ДНК-регистрации призвано обеспечить качественно новый
уровень получения информации и возможность ее использования уже на начальных
стадиях расследования преступлений. В традиционном варианте ДНК-анализа,
используемом при производстве экспертиз вещественных доказательств, исследованию
подвергают интересующий объект (пятно крови, выделений, волос и т.д.), а также
представленный для сравнения образец (подозреваемого, потерпевшего).
Сопоставление выявленных генетических профилей позволяет решить вопрос о наличии
или отсутствии генетического тождества интересующего объекта и образца
проходящего по делу лица. Результаты экспертизы предназначены для того, чтобы
служить доказательством причастности этого лица к преступлению, либо
свидетельствовать в пользу других версий.
Создание автоматизированных компьютерных систем позволит использовать
ДНК-анализ как источник не только доказательственной информации, но и поисковой.
Если при обычном экспертном исследовании данные о происхождении биологического
объекта от конкретного лица можно получить только в случае, если уже проведен
розыск, найден подозреваемый и представлен его сравнительный образец, то при
наличии соответствующей базы данных может быть осуществлен сам поиск этого лица
- путем сопоставления выявленного профиля ДНК с хранящимися в базе данных
генотипами.
Базы данных могут также быть полезными для решения и других задач: (1)
идентификации личности в случае, когда между предоставлением объекта и
сравнительного образца существует значительный временной интервал, (2)
установления связи между преступлениями, (3) идентификации останков неопознанных
лиц при значительном числе вариантов сопоставлений со сравнительными образцами.
Для России эта задача весьма актуальна, в связи с ведущимися на ее территории
военными действиями, актами терроризма и т.д.
Структура системы ДНК-регистрации
Система ДНК-регистрации будет представлять собой автоматизированную
(компьютерную) базу данных о генетических признаках, функционирующую в комплексе
с банком (хранилищем) соответствующего генетического материала (ДНК).
По всей вероятности, федеральная база данных будет аккумулировать информацию,
поставляемую локальными базами данных, формируемыми на базе учреждений,
участвующих в федеральном проекте. Для России централизация обоснована только в
отношении накопления генетической информации, но не ее получения. Это связано с
двумя обстоятельствами: а) значительной территорией страны, делающей мало
осуществимой доставку биологических объектов в одну, выбранную для этой цели
лабораторию, и б) нецелесообразности игнорирования традиционно сложившейся
структуры - существования ДНК-лабораторий в целом ряде регионов страны. Кроме
того, Россия тесно связана с бывшими советскими республиками, которые имеют
собственные экспертно-криминалистические и судебно-медицинские службы,
проводящие ДНК-анализ.
Субъекты федерального проекта
Субъекты федерального проекта должны быть определены соответствующими
государственными программными документами. Федеральными программами 1994-1995 и
1996-1997 годов работа по созданию федеральной базы данных поручалась целому
ряду ведомств - МВД, Минюста, Генпрокуратуры, ФСБ, Минфина, Минздрава. В этот
период экспертизы с использованием методов ДНК-анализа проводились, практически,
в двух ведомствах - МВД и Минздраве. С учетом этого, представлялось
целесообразным создавать базу данных на основе подразделений этих двух ведомств,
организовав работу на паритетных началах. Участие других министерств, указанных
в Федеральной программе, виделось в юридическом, финансовом обеспечении проекта.
В настоящее время подход к организации этой работы представляется в своей
основе тем же. Учитывая, однако, что в настоящее время идентификационные
исследования выполняются в целом ряде лабораторий, не относящихся к МВД и
Минздраву (например, в системах РАМН, РАН), представляется также целесообразным
и их включение в программу, при условии соответствия этих лабораторий
необходимым требованиям.
Принцип функционирования системы ДНК-регистрации
В зависимости от задач, которые будут поставлены перед создаваемой базой
данных, возможны следующие модели ее функционирования.
Модель базы данных, предназначенной для: а) идентификации проходящего по делу
лица в качестве источника происхождения определенного объекта и б) выявления
связи между преступлениями. Для этого нужно создать в базе данных массив
информации о генетических признаках объектов, изъятых с мест нераскрытых
преступлений. При поступлении впоследствии на исследование сравнительного
образца лица, подозреваемого в совершении определенного преступления, определить
его генотип; сопоставить его затем с хранящейся в базе данных генетической
характеристикой и, в случае положительного результата, идентифицировать данное
лицо как источник происхождения интересующего объекта. Для выявления связи между
преступлениями после идентификации проходящего по делу лица как источника
происхождения определенного объекта можно запросить в базе данных информацию об
объектах, изъятых с мест других нераскрытых преступлений. В случае нахождения в
базе данных соответствующего генетического профиля можно установить причастность
данного лица и к другому преступлению.
Такая модель базы данных является в организационном плане наиболее простой,
поскольку основывается лишь на результатах экспертной работы, не требуя
проведения исследования каких-либо специальных контингентов лиц. Поставщиками
данных служат экспертные лаборатории.
Модель базы данных, предназначенной для розыска лиц, совершивших
преступления. Для реализации этой возможности необходимо сформировать массив
генетической информации о контингентах лиц, потенциально представляющих интерес
с точки зрения возможности совершения преступления. С этим массивом информации
будет сопоставляться генетическая характеристика, установленная при исследовании
объекта, относящегося к расследуемому преступлению. В случае совпадения
генетических признаков объекта с одним из профилей ДНК, хранящихся в базе
данных, поиск подозреваемого будет ориентирован в нужном направлении.
Эта модель базы данных требует значительно более сложных механизмов
функционирования. Она также и значительно более дорогостоящая, поскольку для ее
реализации необходимо ДНК-типирование специальных контингентов лиц.
Представляется, что при создании такой базы данных, кроме экспертных
лабораторий, к проекту целесообразно привлечь и другие лаборатории ДНК-анализа
(при условии их соответствия необходимым требованиям) - для типирования
контингентов.
Модель базы данных, предназначенной для идентификации останков неопознанных
лиц. В этом случае в базу данных вносится информация о генотипах, полученных при
типировании останков неопознанных лиц, с которой будут сравниваться данные,
получаемые при ДНК-анализе сравниваемых объектов. Такая модель может служить
целям опознания в следующих случаях:
а) для идентификации останков лиц, предположительно, явившихся жертвами
преступлений. Такие объекты целесообразно типировать в экспертных лабораториях;
б) для идентификации жертв военных действий. Такие объекты логично исследовать в
лабораториях типа Центральной идентификационной лаборатории Министерства обороны
РФ;
в) для идентификации останков жертв террористических актов. Типирование таких
объектов целесообразно осуществлять в экспертных лабораториях или в
лабораториях, специально отведенных или созданных под эту программу;
г) для идентификации останков лиц, погибших при несчастных случаях, природных
катаклизмах и т.д.
Возможно также создание баз данных в связи с определенными категориями
случаев. Например, базы данных в связи с актами терроризма. В этом случае, кроме
информации, полученной при типировании останков жертв, в базу данных могут
вноситься генотипы определенного контингента, проверяемого в качестве
исполнителей террористических актов.
Описанные модели выделены в отдельные базы данных условно. Скорее всего, это
будут различные файлы одной и той же базы данных.
Особенности формирования базы данных о генетических признаках как системы
криминалистического учета
В криминалистике накоплен значительный опыт в области создания информационных
систем, который следует учесть при формировании базы данных о признаках ДНК.
Вместе с тем, в связи с особенностями биологических объектов как вещественных
доказательств и ДНК-анализа как метода исследования, проблема создания базы
данных о генетических признаках является сугубо специфичной и требует
специального подхода ко многим аспектам ее решения.
1) Как уже было указано, создание базы данных о генетических признаках
требует введения единой программы исследования и стандартизации методов. Для
формирования базы данных в масштабе страны необходимо согласие на унификацию
методов со стороны всех лабораторий, участвующих в работе. Это выводит проблему
за рамки какого-либо одного ведомства и делает необходимым обеспечение полной
согласованности в действиях целого ряда ведомств.
2) Объем информации, которую получают в результате типирования ДНК, зависит от
того, какие участки ДНК подвергаются исследованию и каково их количество. Таким
образом, объем информации, получаемой при анализе одного и того же образца,
может быть совершенно различным. Следовательно, создание базы данных требует
решения о том, какой объем информации будет подлежать регистрации. Этим база
данных о генетических признаках кардинально отличается, например, от
дактилоскопической базы данных, регистрирующей весь носитель информации (папиллярный
узор).
3) Степень индивидуальности генетических признаков, вносимых в базу данных,
может быть различной и зависит от частоты встречаемости конкретного генотипа в
популяции. Поэтому совпадение признаков, выявленных в ходе исследования
вещественных доказательств, с признаками, содержащимися в базе данных, не будет
автоматически вести к установлению тождества. Для этого может потребоваться
исследование дополнительных участков ДНК, сведения о которых отсутствуют в базе
данных. Таким образом, не следует ожидать, что положительный ответ на запрос
базы данных будет всегда означать индивидуальную идентификацию интересующего
лица, как это имеет место в случае использования системы дактилоскопического
учета. Тем не менее, даже в случае, когда идентификационная значимость
выявленных признаков недостаточно высока для индивидуализации, полученный
результат не только позволяет сузить круг лиц, которые могут быть потенциальными
источниками обнаруженного объекта, но и служит основой для установления в
дальнейшем тождества.
4) ДНК является носителем всей наследственной информации об индивидууме. Поэтому
принципиально криминалистический ДНК-анализ может быть использован не только для
получения сведений, необходимых для установления тождества, но и служить
источником другой обширной информации о человеке – его предрасположенности к
различным заболеваниям, родстве и т.д. Это создает потенциальную возможность
использования полученных сведений против данного лица (или его родственников) и
диктует необходимость строгого подхода к определению участков ДНК, которые могут
быть подвергнуты типированию и дальнейшей регистрации в базе данных, а также
необходимость предусмотреть механизмы, обеспечивающие соблюдение
конфиденциальности генетической информации [57].
Особенности осуществления ДНК-анализа при использовании его в качестве
основы автоматизированной информационной системы
Работа в области баз данных имеет особенности, по сравнению с обычным
экспертным анализом. Независимо от области применения, исследование ДНК является
сложным технологическим процессом, требующим адекватной материально-технической
базы, высокого методического уровня и совершенства исполнения. Однако, когда
речь идет о криминалистическом ДНК-анализе, а тем более о создании
информационной сети, предназначенной для использования правоохранительными
органами, требования еще более высоки.
Использование результатов ДНК-анализа для внесения в информационную
компьютерную сеть предъявляет дополнительные требования к технологии
исследования. При производстве экспертизы ДНК-анализ проводится как
сравнительное исследование, при котором, как правило, одновременно изучаются
интересующий объект и образцы, представленные для сравнения. Целью такого
исследования является сопоставление выявленных признаков и решение вопроса о
тождестве объектов. При использовании ДНК-анализа как основы базы данных целью
является получение характеристики (символа) признака. Генетическая
характеристика представляет собой обозначение признака, выраженное с помощью
буквенно-цифрового кода. Именно генетическая характеристика вносится в базу
данных для сопоставления в дальнейшем с другими генетическими характеристиками.
Хотя характеристика признака используется и при проведении экспертизы, в этом
случае она обычно служит для конкретизации результата исследования - обозначения
выявленного варианта, оценки его идентификационной значимости при статистической
обработке данных. Во втором случае значимость генетической характеристики
намного выше: она как бы приобретает самостоятельное значение, поскольку именно
она участвует в операциях по использованию базы данных [58].
Несмотря на то, что генетическая характеристика используется в обоих случаях,
отмеченные выше различия в ее функции обусловливают существенные различия в
организации исследования и требованиях, которые к нему предъявляются. Поскольку
экспертное исследование предназначено для решения вопроса в отношении конкретных
объектов, в разных, не связанных между собой экспертизах оно предполагает
возможность вариантов выбора исследуемых генетических систем. В отличие от
этого, работа в области баз данных не может осуществляться без строгой
унификации комплекса генетических систем, используемых в каждом случае
исследования, иначе информация будет несопоставима и база данных не сможет
функционировать. Выбор генетических систем является очень ответственным этапом,
поскольку означает выбор всей технологии исследования и определение необходимого
уровня финансирования.
Существенное значение, даже если речь идет об одной и той же технологии,
имеет также следующее. Исследование объектов, проводимое в рамках экспертизы,
выполняется одним или несколькими экспертами, работающими, как правило, в
условиях одной и той же приборной базы, использующих одни и те же реагенты и
принятые в лаборатории методики. Это к некоторой степени унифицирует
исследование и облегчает сопоставимость результатов исследования разных
образцов. В отличие от этого, база данных предполагает широкомасштабные
исследования, которые осуществляются целым рядом специалистов, работающих в
разных лабораториях и в неодинаковых условиях. Это делает абсолютно необходимым
при создании баз данных унификацию и стандартизацию методик и условий их
выполнения. При этом, используемая для формирования основы базы данных
технология должна быть достаточно гибкой, чтобы позволить использовать ее в
достаточно широком диапазоне вариантов исполнения.
Система ДНК-анализа должна быть отработана настолько, чтобы исключить
возможность неправильной идентификации и обозначения выявленного признака. В
условиях используемых в настоящее время генетических систем это в ряде случаев
представляет трудности, поскольку изучаемые генетические варианты могут
различаться иногда даже лишь по одному нуклеотидному основанию. Кроме того,
анализ является высокочувствительным, что делает необходимым строгое соблюдение
мер антиконтаминационной безопасности, разработку надежной системы интерпретации
результатов исследования.
Все это требует высокой разрешающий способности аналитической системы,
высококачественного оборудования и реагентов, высокой квалификации эксперта.
Необходима единая номенклатура генетических признаков.
С этим связаны положения, изложенные в следующем пункте.
Требования к системе ДНК-типирования, которая будет являться основой
формирования системы ДНК-регистрации
Для обеспечения высокой результативности использования компьютерной базы
данных необходимо иметь эффективную систему ДНК-типирования, являющуюся ее
технологической основой. Эта система должна отвечать следующим требованиям:
Ее базисная технология должна обеспечивать максимально возможную
эффективность в отношении исследования объектов судебно-медицинской экспертизы;
критерием этого служит возможность типирования ДНК с выраженной деградацией и
микроколичеств ДНК.
Для обеспечения федерального учета система должна позволять исследовать в
единицу времени большие количества объектов, хранить соответствующий объем
информации и эффективно его использовать.
Система должна быть унифицированной и стандартизированной, то есть единой для
всех лабораторий, участвующих в формировании базы данных. Всеми участниками
программы должны исследоваться одни и те же участки (локусы) ДНК и применяться
одни и те же методы исследования. В противном случае результаты, полученные в
одной лаборатории, не смогут быть сопоставлены с результатами, полученными в
другой лаборатории, или с результатами, полученными в той же лаборатории, но в
другое время.
4. Отечественная федеральная база данных должна быть совместима с
аналогичными базами данных в других странах и в бывших советских республиках.
Стратегия реализации программы создания в России системы ДНК-регистрации
1) Первоочередной задачей при реализации программы создания базы данных о
генетических признаках, а также хранилищ ДНК, является разработка
соответствующей правовой основы. ДНК является уникальным объектом, поскольку в
ней закодирована вся наследственная информация о человеке. Это создает
потенциальную возможность получения сведений, которые могут быть использованы
против личности. Регламентации должны подлежать следующие ключевые моменты: (а)
определение контингента лиц, генетические профили которых могут вноситься в базу
данных, а ДНК - оставаться в хранилище; (б) характер генетической информации,
которую разрешено использовать для целей расследования и раскрытия преступлений;
(в) сроки хранения информации в базе данных и источника ДНК (следов крови,
выделений и т.д.) в соответствующем хранилище; (г) требования к обеспечению
конфиденциальности информации и многие другие аспекты. От принятых правовых
регламентаций будут зависеть пути и формы реализации программы.
2) Важным вопросом является выбор технологии. Обусловленность информации,
вносимой в базу данных, использованием определенных методов исследования ведет к
возникновению проблем, связанных с появлением новых, более совершенных
технологий. Неизбежно, что любая подобная база данных рано или поздно подлежит
замене, при этом существование большого массива накопленной информации будет
невольно препятствовать переводу ДНК-анализу на новый, более высокий
технологический уровень. Для того чтобы обеспечить максимальный «срок жизни»
создаваемой базы данных, необходимо формировать ее на основе самых передовых из
существующих методов, с использованием новейших перспективных научных
разработок, даже если это потребует больших материальных затрат. В противном
случае база данных может морально устареть раньше, чем начнет широко
применяться, и затраты будут несоизмеримо выше.
3) Исследование ДНК является трудоемким процессом, требующим значительных
материальных затрат и высокого профессионального уровня исполнителей. Это
создает ограничения в количестве образцов, которые могут быть исследованы и
зарегистрированы в базе данных. В связи с этим определение категорий лиц,
информация о которых будет вноситься в базу данных, должно производиться с
учетом ценности ее для раскрытия определенных категорий преступлений. Известно,
что наиболее часто биологические объекты, содержащие ДНК, обнаруживаются в связи
с преступлениями против личности – убийствами, нанесением телесных повреждений
и, в особенности, с половыми преступлениями. В последнем случае результаты
исследования ДНК имеют наибольшую доказательственную ценность. Так, например,
обнаружение спермы конкретного мужчины в вагинальном содержимом потерпевшей
однозначно свидетельствует о факте полового сношения с ней этого лица, что часто
имеет решающее значение для следствия и суда. Таким образом, формирование базы
данных о генетических признаках целесообразно начать прежде всего по случаям
половых преступлений, при наличии соответствующих материальных и технических
условий расширяя область ее применения и охватывая другие тяжкие преступления
против личности.
Контингентом, наиболее целесообразным с точки зрения генетической регистрации,
являются лица, проходившие ранее по уголовным делам, поскольку среди них высок
уровень рецидивизма. Так, согласно данным Бюро правовой статистики США [24], 60%
лиц, осужденных за преступления, связанные с насилием против личности, в течение
3-х лет после освобождения из тюрьмы были вновь арестованы за сходные
преступления, 42% - вновь осуждены.
4) Детальная разработка проекта возможна только после решения на федеральном
уровне вопроса о его финансировании и выработке соответствующих правовых
регламентаций. Однако, учитывая актуальность проблемы для правоохранительных
органов, представлялось целесообразным уже сейчас, в рамках существующего
законодательства об экспертной деятельности и на базе имеющихся материальных
ресурсов, начать работу в соответствующем направлении. Хотя автоматизированная
информационная система генотипоскопического учета будет функционировать в
комплексе с банком ДНК – хранилищем генетического материала, существование банка
ДНК возможно и вне связи с компьютерной базой данных – для экспертной работы. С
целью повышения эффективности судебно-биологической экспертизы и в качестве
первого этапа реализации программы создания базы данных по случаям половых
преступлений рекомендуется начать работу по формированию в ЭКП ОВД банка ДНК по
случаям половых преступлений [59,60].
Прогноз динамики эффективности базы данных
Представляется, что по мере функционирования базы данных (и это предположение
подтверждается опытом практического использования зарубежных баз данных)
эффективность их будет прогрессивно возрастать. Увеличение числа совпадений с
генетичеcкими профилями, хранящимися в базе данных, можно ожидать за счет двух
процессов: (1) экстенсивного расширения базы данных (внесения в нее все большего
количества генетических профилей); (2) более интенсивного использования уже
имеющегося объема информации.
В настоящее время рост эффективности работы баз данных осуществляется,
по-видимому, преимущественно за счет увеличения числа единиц информации. С
течением времени можно ожидать все более активного использования имеющихся
массивов информации, например, относящейся к образцам осужденных: базы данных
начали создаваться лишь недавно, и многие из этих лиц еще находятся в местах
лишения свободы. Таким образом, потенциал созданных баз данных, по-видимому, еще
только начинает реализовываться.
3.2. Выбор технологии ДНК-анализа
Технологический базис системы ДНК-регистрации должен строиться на основе
решения вопроса о том, исследование каких участков ДНК следует положить в основу
типирования и какие методы для этого использовать. Эта проблема была рассмотрена
применительно к исследованию различных групп локусов, с учетом не только
аргументов научного характера, но и того, как эта технология будет вписываться в
реальные условия, в которых придется осуществлять данную программу (в том числе,
финансового характера).
Анализ различных групп локусов
Используя известные в науке положения, а также результаты собственных
исследований, провели анализ по следующим позициям: (а) информативность локуса
(уровень полиморфизма локуса и идентификационная значимость аллельных
вариантов); (б) возможность типирования деградированной ДНК; (в) изученность
локуса с точки зрения его пригодности для исследования объектов
судебно-медицинской экспертизы; (г) возможность создания на основе применяющейся
техники автоматизированной системы; (д) стоимость исследования и реальность
формирования в наших условиях соответствующей материально-технической базы.
VNTR-локусы. Данная группа локусов применительно к проблеме создания базы
данных имеет следующие достоинства: (1) VNTR-локусы представляют собой
гипервариабельные, т.е. высокополиморфные участки генома. Этим локусам
свойственен высокий уровень мутаций (1% на поколение), что обусловливает большой
спектр аллельных вариантов. (2) Они относятся к некодирующим областям. (3)
Молекулярно-генетическая основа VNTR-анализа хорошо изучена, проведены
валидационные судебно-медицинские исследования. (4) Методы исследования
VNTR-локусов доступны для использования в обычных лабораториях ДНК-анализа. Для
их выполнения пригодно имеющееся в этих лабораториях оборудование. Реагенты,
необходимые для исследования этих локусов, выпускаются отечественными
изготовителями.
Тем не менее, применение методов VNTR-анализа для формирования базы данных
нецелесообразно ввиду следующих обстоятельств: (1) Аллелям этих локусов
соответствуют довольно длинные (несколько сот пар оснований) последовательности
ДНК, что ограничивает возможность их исследования в условиях деградации ДНК,
поскольку ведет к получению отрицательного результата (отсутствие генетического
профиля). (2) При деградации, в связи с проявлением эффекта так называемой
преимущественной амплификации, не всегда может быть получена полная аллельная
характеристика; выявление же неполного аллельного профиля затрудняет
интерпретацию результатов.
Исследование кодирующих областей ДНК. Для исследования локусов HLA DQА1 и «POLYMARKER»
(LDLR, GYPA, HBGG, D7S8, GC) существовуют стандартные, сертифицированные
тест-системы, методики хорошо отработаны, собраны данные о распределении
признаков в различных зарубежных популяциях (в ограниченном объеме - и в
отечественных). Исследование этих локусов достаточно эффективно с точки зрения
возможности типирования объектов, обладающих особенностями экспертного материала
(малые количества, разрушенная ДНК).
Однако данная группа локусов также не оптимальна в качестве основы для
создания базы данных по следующим причинам: (1) Информативность исследования
данных локусов относительно невысока. (2) Исследование с использованием данных
тест-систем является крайне дорогостоящим. Выполнение такой масштабной
программы, как создание национальной базы данных, потребует неоправданно
огромных затрат, тогда как существуют более экономичные тест-системы (для
типирования STR-локусов). (3) Типирование кодирующих областей ДНК и, главное,
хранение и использование информации о них в большинстве стран с этической и
правовой точек зрения признано нежелательным либо запрещено совсем. Таким
образом, как бы ни решалась данная проблема в этическом и правовом отношениях в
нашей стране, создание базы данных на основе кодирующих последовательностей ДНК
в любом случае нецелесообразно, т.к. такая база данных будет существовать
изолированно от баз данных, создаваемых в других странах.
STR-локусы. Как и VNTR-локусы, STR-локусы относятся к некодирующим
гипервариабельным регионам. Эти локусы широко распространены в геноме человека:
в настоящее время известно более 20 тысяч STR-локусов. STR-локусам свойственны
наиболее короткие амплифицируемые последовательности и, следовательно, они
обладают наибольшими возможностями в отношении типирования деградированной ДНК.
Эти локусы имеют ряд других преимуществ, существенных для исследования
деградированной ДНК. Поскольку они относятся к одному семейству генетических
маркеров, их анализ осуществляется в рамках одной и той же технологии;
компактный диапазон аллельных вариантов (в пределах 30–50 п.н.о. в локусе 8–12
аллелей) позволяет создавать комплексные диагностические системы, обеспечивающие
возможность одновременного исследования сразу нескольких локусов. Это важно для
исследования ДНК с выраженной деградацией, когда в объекте нередко имеется лишь
ограниченное количество фрагментов ДНК, пригодных для анализа. С помощью
STR-типирования на одной и той же матрице проводится изучение сразу нескольких
участков, что обеспечивает высокую чувствительность системы. STR-анализ хорошо
поддается автоматизации.
Все эти факторы делают предпочтительным исследование именно этой группы
локусов при создании баз данных.
Полиморфные локусы Y-хромосомы. Полиморфизм Y-хромосомы изучается
сравнительно недавно. Y-хромосома является носителем различных видов
полиморфизма. Бинарный полиморфизм связан с вариациями по одному нуклеотиду (SNP
- single nucleotide polymorphisms). Хотя SNP-маркеры, если их взять по
отдельности, имеют низкий полиморфизм (информативность их составляет 20-30% от
информативности STR-маркеров), они имеют большое распространение в геноме,
встречаясь с частотой 1 на 1 тыс. п.н.о. (STR-локусы - в среднем 1 на 15 тыс.
п.н.о.). Большая протяженность Y-хромосомы дает почву для накопления таких
изменений: в современной популяции Y-хромосом можно ожидать существование тысяч
таких замен оснований. Это может позволить создавать высокоинформативные
комплексные системы анализа, которые, возможно, будут пригодны не только для
экспертизы вещественных доказательств, но и для создания баз данных. Однако пока
еще технология исследования этой группы локусов отработана недостаточно, чтобы
говорить об этом определенно.
Локусы с мультиаллельным полиморфизмом включают в себя мини- и микросателлиты
и представляют собой значительно более реальную основу для технологии создания
баз данных. Микросателлиты (STR-локусы) в особенности перспективны для задач
создания баз данных по тем же причинам, что и аутосомные STR-локусы, о которых
шла речь выше.
Следует учитывать, что анализ Y-хромосомы позволяет работать только с мужским
биологическим материалом, а судебно-медицинскими объектами могут являться также
образцы, происшедшие от женщин. Поэтому методы исследования локусов Y-хромосомы
могут быть только частью технологического комплекса, используемого при создании
баз данных. Валидационные судебно-медицинские исследования этих локусов
проводятся, однако выполнены еще не в полном объеме.
Митохондриальная ДНК. В идентификационных исследованиях также используется
митохондриальный ДНК-анализ. Многокопийность митохондриальных генов сообщает
анализу высокую чувствительность, делает возможным исследование образцов с
минимальными количествами ДНК и выраженными изменениями. Высокую устойчивость
митохондриальной ДНК обеспечивает ее кольцевидная структура. Митохондриальный
анализ позволяет производить типирование объектов с очень большими сроками
давности. Существенной является возможность его использования для исследования
объектов, типирование которых с помощью маркеров ядерной ДНК представляет
затруднения в силу малого количества в них ядерной ДНК, - cтержней волос,
костей, зубов. Все это позволяет оценивать митохондриальные маркеры как ценные
для задач базы данных.
В то же время, исследование митохондриальный ДНК-анализ имеет серьезные
ограничения: (1) Он не обеспечивает той высокой информативности, которая
возможна при исследовании ядерных маркеров. Митохондриальная ДНК идентична у
лиц, родственных по материнской линии. (2) Высокая стоимость и трудоемкость не
позволяют использовать митохондриальный анализ как рутинный метод.
Таким образом, митохондриальный ДНК-анализ не может использоваться в системах
ДНК-регистрации в качестве основного метода. Тем не менее, он может
использоваться в качестве дополнительного метода и особое значение иметь в
некоторых файлах (например, относящихся к идентификационным исследованиям
останков неопознанных лиц).
Возможные уровни решения проблемы
Результаты проведенного анализа позволили составить программу исследования.
Нами был разработан принципиальный подход к выбору технологии, основанный на
рассмотрении 3-х уровней решения этой проблемы [61]. Анализ рассмотренных
возможных вариантов позволил прийти к выводу о том, что базу данных о
генетических признаках целесообразно создавать на основе технологии
автоматизированного типирования STR-локусов с флюоресцентным мечением продуктов
амплификации и фракционированием их с помощью секвенатора (вариант 1 III
уровня).
В настоящее время эта стратегия остается целесообразной. С учетом развития
молекулярной генетики и технологии можно предложить к ней следующие дополнения:
1) принимая во внимание большую актуальность баз данных для случаев половых
преступлений, рекомендуется включение в состав типируемых локусов также
STR-локусов Y-хромосомы;
2) повышение пропускной способности капиллярного электрофореза (модель ABI
PRISM 3100 имеет уже 16 капилляров) делает его реальной альтернативой
секвенатору;
3) целесообразно рассмотреть возможности введения новых технологий
типирования. Например, разработка миниатюрных электрофоретических устройств
(микрочипов), содержащих ультратонкие микроканалы, позволяет за счет коротких
разгонок достичь очень высокой скорости проведения анализа. Так, для
квадриплексной STR-системы CTTv-анализ может быть проведен с использованием 3 см
разгонки менее чем за 2 минуты [62], что значительно превышает скорость анализа
при применении секвенатора, а также обычной техники капиллярного электрофореза.
Существенно, что эти технологии позволяют исследовать те же локусы (но только за
более короткое время) и, следовательно, позволяют работать в рамках имеющихся
баз данных. Целесообразно рассмотреть ряд других новых подходов к исследованию
ПЦР-продуктов [63].
3.3. Разработка вопросов создания банка ДНК как хранилища генетического
материала
Создание федеральной базы данных предполагает комплексный подход к решению
проблемы и требует поэтапной реализации. Одним из первых этапов, который реально
осуществить за сравнительно короткий срок, представляется формирование на базе
ЭКП банков ДНК, в перспективе используемых в комплексе с компьютерной базой
данных, но имеющих самостоятельное значение уже на этом этапе. Для того чтобы
объекты, содержащие ДНК, могли при необходимости быть типированы в дальнейшем,
они должны храниться в особых условиях. При существующем порядке их хранения
такие условия не обеспечиваются, что вызывает разрушение ДНК и часто делает
невозможным ее исследование. Кроме того, после проведения экспертизы нередко
остается не израсходованная в процессе исследования часть пробы выделенной ДНК,
которая при наличии банка ДНК также могла бы быть сохранена для последующего
типирования. Банк ДНК – это специализированное хранилище биологических объектов
(следов) и ДНК, выделенной в процессе проведения судебно-биологической
экспертиз. Назначение банка ДНК - эффективное сохранение генетического материала
для проведения в случае необходимости дополнительного или повторного
исследования объекта.
Исследование объектов, хранящихся в банке ДНК с экспертными целями,
предполагалось осуществлять в следующих случаях: (1) При поступлении
сравнительных образцов подозреваемых, если при первичном исследовании они
отсутствовали и ДНК-типирование не проводилось. (2) При поступлении
сравнительных образцов новых подозреваемых в случае исключения при первичном
исследовании возможности происхождения объекта от лица, образцы которого были
представлены ранее. (3) При целесообразности исследования дополнительных
генетических маркеров, которые не могли быть исследованы ранее. (4) При
возникновении оснований для проведения повторной экспертизы. Создание банка ДНК
позволит с максимальной эффективностью использовать для исследования
генетический материал и обеспечит возможность контроля достоверности результатов
ДНК-анализа.
Была разработана регистрационная документация банка ДНК [60,61].
В 1995-1996 г.г. на базе Экспертно-криминалистического центра был создан
экспериментальный банк ДНК по делам о половых преступлениях. Банк представлял
собой хранилище ДНК, оставленной после проведения судебно-биологических
экспертиз. При банке имелся архив, в котором хранилась регистрационная
документация - информационные карты. Информационная карта в экспериментальном
банке заполнялась для каждой экспертизы по делам о половых преступлениях.
В 1998 г. нами была обобщена генетическая информация по экспертизам,
выполненным с использованием STR-анализа в ЭКП органов внутренних дел России.
Созданная база данных являлась моделью; она не предназначалась для целей
расследования и раскрытия преступлений, создаваясь и используясь только как
популяционная (популяционные данные были опубликованы нами в источнике [16]).
Всего в базу данных было внесено 749 профилей. Указанные профили были получены
при исследовании образцов 210 лиц. Эта база данных, как и архив банка ДНК,
явились прообразом компьютерной базы данных, которую предполагается сформировать
в будущем. Данная модель позволила изучить и уточнить ряд положений, касающихся
создания и функционирования системы генетических учетов.
3.4. Практические мероприятия по подготовке к реализации программы создания
федеральной системы ДНК-регистрации
Организационная деятельность касалась подготовки к реализации программы. Она
являлась федеральной программой и требовала консолидации усилий целого ряда
учреждений и ведомств.
В экспертно-криминалистической службе органов внутренних дел с этой целью
было осуществлено: (1) Разработанные по данной проблеме материалы направлены в
региональные ЭКП МВД РФ. (2) Проблема создания системы ДНК-регистрации
освещалась на Всероссийских семинарах экспертов-биологов ОВД РФ. (3) Вопросы
создания системы ДНК-регистрации были введены в программы обучения на
стажировках экспертов. (4) Формирование материально-технической базы лабораторий
ДНК-анализа региональных ЭКП осуществлялось с учетом планируемой программы. (5)
В практику региональных ЭКП интенсивно вводилась методология STR-анализа. (6) С
целью контроля за экспертной работой, а также изучения уровня и методической
готовности региональных ЭКП к выполнению STR-анализа, проводились тотальные
проверки заключений по экспертизам, выполненным с использованием ДНК-анализа в
региональных ЭКП. Данные проверки имели также своей целью осуществить реальную
координацию Экспертно-криминалистическим центром исследованиями по ДНК-анализу в
экспертно-криминалистической службе ОВД, необходимую для деятельности по
созданию федеральной системы ДНК-регистрации.
На межведомственном уровне с целью интеграции были организованы
межведомственные совещания по вопросам создания системы генетических учетов.
На международном уровне интеграция осуществлялась в рамках участия в
международной программе по созданию общеевропейской базы генетических данных,
разрабатываемой рабочей группе по ДНК-анализу Европейской сети
научно-криминалистических учреждений (European network of forensic scientific
institutions - ENFSI). Ее задачей являлась координация деятельности европейских
лабораторий для обеспечения максимальной эффективности судебно-медицинского
ДНК-анализа, унификации методов, разработки общеевропейских стандартов
применительно к созданию баз данных, механизмов обеспечения совместимости баз
данных, формируемых в странах Европы.
Отдельные положения концепции нашли отражение в целом ряде документов, в
частности, представленных в Межведомственную комиссию Совета безопасности
Российской Федерации по борьбе с преступностью. На основании данных Главного
информационного центра МВД России были представлены: предполагаемый объем
исследований на начальном и последующих этапах формирования базы данных;
примерный расчет необходимого количества лабораторий ДНК-анализа и площадей для
их формирования, числа штатных единиц, стартового финансирования
материально-технической базы, а также ежегодных расходов на приобретение
расходных материалов и денежное содержание сотрудников.
К сожалению, финансирование данного проекта до настоящего время не
осуществлено.
4. РАЗРАБОТКА МЕТОДИЧЕСКИХ И ПРАКТИЧЕСКИХ ВОПРОСОВ ПОДГОТОВКИ ЭКСПЕРТНЫХ
КАДРОВ ПО СУДЕБНО-МЕДИЦИНСКОЙ ДНК-ИДЕНТИФИКАЦИИ
Задача разработки системы экспертной ДНК-идентификации поставила также задачу
разработки методологии подготовки по данному направлению экспертных кадров. В
связи с новизной направления, какого-либо аналога такой системы не было ни в
нашей стране, ни за рубежом.
4.1. Подготовка экспертных кадров по ДНК-идентификации в
экспертно-криминалистической службе органов внутренних дел РФ
В 1993 году началась подготовка кадров для лабораторий ДНК-анализа
региональных экспертно-криминалистических подразделений МВД. В 1994 году имелось
8, а 1996 году - уже 15 лабораторий ДНК-анализа. Для всех этих лабораторий нами
в 1994-1996 годах были подготовлены эксперты соответствующего профиля; обучение
экспертов продолжалось и в последующие годы.
Проблема подготовки кадров комплексная и включала в себя работу по следующим
направлениям: (1) Разработка программ обучения и проведение по ним циклов
стажировок. (2) Подготовка методического обеспечения. (3) Контроль экспертной
работы посредством рецензирования экспертных заключений. (4) Проведение
Всероссийских экспертных семинаров по ДНК-идентификации. (5) Командировки в
региональные лаборатории по оказанию практической помощи. (6) Текущая
консультативная помощь по проблемам, связанным с формированием лабораторий и
проведением экспертиз.
Разработка программ обучения и проведение циклов стажировок по
ДНК-идентификации первого и второго уровней
Программы стажировок находились в тесной взаимосвязи с научной разработкой
ДНК-идентификации, отражая состояние ее развития. В связи с постоянным
совершенствованием методического комплекса, каждый цикл обучения имел некоторые
отличия от предыдущих.
Стажировки первого уровня
Стажировки первого уровня выполняли функцию циклов специализации. На
стажировку направлялись эксперты, имеющие опыт работы (обычно – несколько лет) в
области судебно-биологической экспертизы.
Программа стажировки включала в себя лекции и практические занятия. Занятия
проводились интенсивно, в течение 8 часов ежедневно, индивидуально или в
небольших группах (по 2-3 человека). План каждого рабочего дня составлялся таким
образом, чтобы обеспечить максимально эффективное использование времени, не
допуская его потерь в технологические перерывы - все промежутки во время
инкубации, электрофореза и т.д. были заняты объяснением теоретического материала
или выполнением стажерами какой-либо иной лабораторной процедуры. Такой подход
обеспечивал возможность за короткий срок – в пределах месяца (проводить более
продолжительные стажировки не позволяли условия) провести изучение достаточно
большого объема теоретического материала и обучить наиболее важным практическим
навыкам.
Стажировки второго уровня
Стажировка второго уровня проводилась с целью дальнейшего теоретического
изучения и практического освоения ДНК-идентификации, рассмотрению более сложных
ее вопросов. Так, эксперты, не изучавшие во время первой стажировки STR-анализ
(в силу того, что в этот период он еще был недостаточно разработан), делали это
на стажировке второго уровня. Если на стажировке первого уровня объектами
исследования служили преимущественно следы крови и спермы, то на стажировке
второго уровня речь шла об исследовании костной ткани, волос. Рассматривались
вопросы проведения экспертизы, связанной с идентификацией останков неизвестных
лиц. Обсуждались сложные случаи математической обработки данных. Изучался ряд
теоретических аспектов исследования ДНК, знание которых существенно для
правильного применения методов. Важной частью стажировки являлись анализ
выполненных стажером экспертиз, обсуждение вопросов, вызвавших у стажера
затруднения.
Разработанные и апробированные в системе МВД программы стажировок в
дальнейшем явились основой «Унифицированной программы последипломного обучения
врачей по судебно-медицинской экспертизе» (применительно к ДНК-идентификации).
Подготовка методических материалов
Методические материалы требовались как для освоения методов, так и для
дальнейшей работы экспертов. С этой целью по различным вопросам
ДНК-идентификации было подготовлено 6 методических рекомендаций. Их составляли
таким образом, чтобы эксперты могли воспроизвести данный вид исследования от
начала до конца. Однако эти материалы освещали не только техническую сторону
метода, но и представляли методический подход к данному виду экспертного
исследования, остающийся актуальным и для исследования других маркеров.
Было также подготовлено справочное пособие «ДНК в вопросах и ответах». Оно
предназначалось для начального этапа обучения экспертов, а также для
следователей, судей, адвокатов.
Рецензирование экспертных заключений
Было проведено рецензирование более 200 экспертных заключений по экспертизам,
выполненным с использованием методов исследования ДНК в региональных ЭКП. По
результатам рецензирования для каждого эксперта готовился письменный материал, в
котором детально анализировались все представленные заключения. Кроме того,
результаты анализа экспертной практики систематизировались и докладывались нами
на Всероссийских семинарах экспертов-биологов.
Уже первая тотальная проверка экспертных заключений по ДНК-идентификации,
проведенная в 1997 году, показала, что экспертам удалось интегрировать методы
ДНК-анализа в экспертизу вещественных доказательств, сделав их не автономным
видом исследования, а частью экспертного методического комплекса. При этом
подходе ДНК-анализ служил общим задачам экспертизы. На наш взгляд, это оказалось
возможным во многом благодаря тому подходу к подготовке экспертных кадров,
который использовался в экспертно-криминалистической службе органов внутренних
дел. Эксперты приступают к изучению методов ДНК-анализа уже после освоения ими
традиционных методов экспертизы биологических объектов и получения достаточного
опыта в их применении. Эксперты, выполняющие исследование ДНК, как правило,
проводят всю экспертизу целиком, что позволяет им использовать наиболее
рациональные пути исследования. Если даже они по каким-то причинам выполняют
только ДНК-анализ, они хорошо понимают результаты тех исследований, которые были
проведены ранее. Разумеется, речь идет о тенденции. И на семинарах, и в процессе
текущей работы обсуждались случаи, когда совокупность данных по экспертизе
оценивалась не полной мере.
Анализируя экспертизы, выполненные в тот или иной период времени, необходимо
учитывать объективные условия, в которых велась экспертная работа. Так, на
начальных этапах деятельности, в середине 90-х годов, лаборатории испытывали
немало сложностей, связанных с тем, что реагенты, имевшиеся на отечественном
рынке, не имели полной комплектации и стандартного качества. Например, в наборах
отсутствовала тестированная контрольная матрица; аллельные лэддеры в ряде
случаев имели неполный диапазон аллельных вариантов, либо отмечался сдвиг
какого-либо фрагмента; не всегда хорошо работали праймеры или Taq-полимераза.
Все это значительно затрудняло выполнение экспертизы и предъявляло более высокие
требования к порядку ее проведения. Не случайно поэтому, что именно к данному
периоду относится большая часть замечаний, сделанных во время рецензирования. В
более поздний период экспертизы выполнялись на значительно более высоком уровне.
В определенной степени это было связано с тем, что экспертизы стали выполняться,
как правило, с использованием стандартных тест-систем. Немаловажно было и то,
что к этому времени эксперты уже приобрели опыт, появились наработанные схемы,
была налажена работа в лабораториях.
Экспертизы различались по уровню их исполнения, что, с одной стороны,
зависело от технических возможностей лаборатории, а с другой, определялось
квалификацией и индивидуальностью эксперта. Более весомо воспринимались
заключения, в которых эксперт анализировал по ходу проведения экспертизы
получаемые им данные, давал пояснения в отношении стратегии дальнейшего
исследования. Это показывало логику исследования, придавало экспертизе
индивидуальность, "штучность".
Далее мы проведем краткий анализ тех моментов экспертных заключений, которые
вызвали у нас замечания. В этом анализе будут также участвовать экспертизы,
выполненные в системе Минздрава, с которыми нам также неоднократно приходилось
знакомиться. Поскольку обсуждаются вопросы методологии ДНК-идентификации в
целом, наши наблюдения будут обобщены безотносительно к тому, где было выполнено
исследование.
Систематизация отмеченных в экспертизах недостатков позволила отнести их к:
(1) методической части, (2) интерпретации результатов исследования, (3)
вероятностным расчетам, (4) представлению в заключении хода и результатов
исследования, (5) формулированию выводов.
Недостатки методического характера чаще всего были связаны с отсутствием в
ряде случаев в исследовании контрольных тестов (или какого-либо из них).
Контрольные тесты являются неотъемлемой частью исследования и их отсутствие
лишает результаты достоверности.
Недостаточная разрешающая способность использованной электрофоретической
системы ставила в ряде случаев под сомнение правильность идентификации
выявленных аллельных фрагментов, что касалось, преимущественно, исследования
локуса ТН01, типирование которого требует разрешения, позволяющего
дифференцировать фрагменты, различающиеся по 1 п.н.о. Не всегда был правильным
порядок нанесения проб при электрофоретическом исследовании. Если идентификация
фрагментов проводится на основании визуального сопоставления уровня расположения
фрагментов с аллельным лэддером, то порядок нанесения проб для электрофореза
должен быть таким, чтобы обеспечить возможность однозначной интерпретации при
идентификации аллельных вариантов. В некоторых экспертизах это не соблюдалось.
В ряде экспертиз, в которых проводилось выделение ДНК фенольным методом, не
оценивались количество и качественное состояние выделенной ДНК. Отсутствие этого
этапа не позволяет оптимизировать вводимое в ПЦР количество матрицы, а также, в
случае отрицательного результата ПЦР, затрудняет объяснение возможной его
причины.
Неодновременное исследование интересующего объекта и образца для сравнения,
когда эти объекты иследуются в разных сериях опыта, требует строгой
стандартизации условий - использования стандартных реагентов и, разумеется,
выполнения всех необходимых контрольных тестов. В противном случае результаты
этих исследований могут быть не сопоставимы. В некоторых экспертизах объекты
исследовались в разных сериях опыта при использовании нестандартных реагентов и
в отсутствие строгой верификации результатов идентификации аллелей.
В некоторых случаях экспертное исследование было недостаточно полным. Иногда
это касалось того, что не были включены необходимые сравнительные образцы. Так,
в ряде экспертиз, проводимых по случаям спорного отцовства, не исследовался
образец крови матери ребенка, либо исследование образца матери было проведено не
по всем изучавшимся в экспертизе локусам.
Нам также встретилась экспертиза, в которой в качестве сравнительного образца
исследовалась кровь только одного из двух проходящих по данному делу лиц. Так,
исследуя (по двум локусам) пятно крови на изъятой у подозреваемого одежде,
эксперт ограничился исследованием в качестве сравнительного образца лишь образца
крови потерпевшей. Образец же крови подозреваемого, на вещах которого и было
обнаружено это пятно, не исследовался и в заключении не фигурировал вообще.
Порядок проведения экспертизы таков, что независимо от того, как сформулирован
вопрос следователя, она должна включать в себя исследование обоих
дифференцируемых образцов; нецелесообразно вообще начинать экспертизу до
предоставления всех необходимых образцов, поскольку результаты должны
оцениваться в целом и в случае положительного, и в случае отрицательного
результата. В обсуждаемой экспертизе это было тем более необходимо в силу целого
ряда обстоятельств: кровь обоих проходящих по делу лиц относилась к одной и той
же группе по системе АВО; согласно выводам первичной экспертизы, исследуемый
объект был «смешанным»; выводы, сделанные при данной экспертизе, находились в
полном противоречии с выводами, сделанными при предыдущих экспертизах.
В том же заключении обращал на себя внимание и другой момент. Выполненные
экспертом описание объекта и ДНК-типирование касались лишь вырезки со следами
крови, исследованной при предыдущей экспертизе. Сам же предмет одежды, из
которого была сделана вырезка, экспертом даже не был описан. Исключив
возможность происхождения крови от потерпевшей, что шло вразрез сделанному в
категорической форме противоположному выводу при предыдущей экспертизе, а также
вероятностному выводу при еще более ранней экспертизе, эксперт закончил на этом
исследование, не выполнив ряда других исследований, которые могли быть в данном
случае полезными для объяснения возникшей ситуации, а также не сделав попытки
поиска каких-либо иных следов на этой одежде.
Еще одним методическим недостатком, отмеченным в той же экспертизе, являлось
использование в ней для окрашивания ПААГ (исследовался локус ТН01) бромистого
этидия вместо нитрата серебра. Применительно к исследованию STR-локусов
последний предпочтителен. В данной экспертизе целесообразность этого способа
окрашивания была обусловлена двумя обстоятельствами и видна уже из исходных
данных. Во-первых, при первичной экспертизе было выявлено, что объект
«смешанный», содержит кровь и буккальный эпителий. Во-вторых, эксперт,
проводивший уже данное исследование, отметил деградацию ДНК. Принимая во
внимание гетерогенность генетического материала (в отношении которого не
известно, от одного или разных индивидуумов он произошел), а также его
деградацию (что уменьшало количество фрагментов, пригодных для амплификации),
целесообразным являлось использование более чувствительного способа детекции –
окрашивания серебром вместо бромистого этидия. В случае, если в смеси
присутствовал минорный компонент с аллельными вариантами, отличающимися от
присущих основному компоненту, это повысило бы вероятность их выявления. Мы
вернемся к этой экспертизе также далее.
Отмеченный в ряде случаев необоснованно большой объем исследований по
экспертизе, разумеется, ошибкой не является, однако, в силу высокой стоимости
исследования, он не целесообразен. В одной из экспертиз методами ДНК-анализа
были исследованы многочисленные следы крови на большом количестве предметов
одежды, в которой потерпевший с наружным кровотечением (проникающее ножевое
ранение) поступил в больницу, где скончался. Группа крови во всех следах была
идентична группе крови самого потерпевшего; подозреваемого у следствия еще не
было. В этих условиях проведение анализа ДНК для исследования большого
количества объектов не было обоснованным.
Недостатки в части интерпретации результатов исследования были связаны с
недостаточно тщательным анализом выявленных амплифицированных фрагментов,
дифференциацией аллельных и артефактных фрагментов, что в ряде случаев ставило
под сомнение достоверность установленных аллельных характеристик. В частности,
не всегда правильно интерпретировались статтерные фрагменты при STR-анализе.
Требовало обсуждения выявление сдвига амплифицированных фрагментов относительно
фрагментов аллельного лэддера.
Замечания вызывало в ряде случаев исследование "смешанных" следов. Например,
иногда игнорировалась возможность того, что фракции, полученные после
"дифференциального лизиса", могут иметь достаточно сложный состав и содержать
ДНК разных лиц. Не учитывалась при интерпретации также возможность неодинаковой
подверженности к деградации разных компонентов смеси, следствием чего могла
являться преимущественная амплификация одних компонентов смеси при полноценной
амплификации других, либо неодинаковая способность ДНК к амплификации по разным
локусам. Описанная проблема интерпретации была особенно актуальна для экспертиз
«раннего» периода, в силу двух обстоятельств: исследование в это время
проводилось, в основном, по VNTR-локусам, в которых преимущественная
амплификация наиболее вероятна; кроме того, в исследовании участвовало лишь
небольшое число генетических маркеров, что также делало интерпретацию
результатов «смешанных» следов более сложной.
Противоположной ситуацией является гипердиагностика смесей. Хотя любой
неизвестный объект, потенциально, может быть «смешанным», при отсутствии
реальных признаков, указывающих на гетерогенную природу пятна, тактика его
исследования и интерпретация результатов должны быть дифференцированными в
зависимости от случая и строиться с учетом таких важных экспертных
характеристик, как локализация исследуемых пятен, их количество, форма, размеры,
цвет, характер контуров и т.д. В некоторых экспертизах этот момент упускался из
виду. Например, при исследовании пятен крови на мужской сорочке, изъятой у лица,
подозревавшегося в убийстве своей матери, эксперт, выявив во всех следах
«мужской» амелогениновый профиль, но допустив возможность наличия смеси мужской
и женской крови и камуфлирования «женского» профиля ДНК «мужским», провел далее
исследование всех этих следов также и по полиморфным локусам. Результаты
исследования подтвердили версию о происхождении следов от самого подозреваемого.
В этих условиях, учитывая характер объектов (серия однотипных следов, очень
малых размеров, с четко очерченными контурами), практически исключавший
возможность образования всего множества этих следов за счет крови двух лиц,
можно было ограничиться исследованием в полном объеме лишь одного из пятен этой
серии, а остальные исследовать лишь по амелогениновому маркеру.
Если гипердиагностика смесей обусловливает, как в данном случае, только
излишний объем исследования, это, в сущности, недостатком не является. В других
случаях гипердиагностика смесей может вести к формулированию выводов,
дезориентирующих следователя. Это относится к ситуации, аналогичной той, если во
всех следах крови группы А (II), независимо от их характера и обстоятельств
дела, не исключать возможность присутствия крови группы 0 (I).
Важным моментом является правильное соотнесение результатов ДНК-анализа и
других исследований. В одной из экспертиз при исследовании пятна крови на брюках
подозреваемого по системе АВО были получены данные, исключавшие ее происхождение
от подозреваемого и свидетельствовавшие о возможности происхождения от
потерпевшей. Этот же эксперт, однако, провел дополнительно исследование и по
двум полиморфным локусам, результаты которого не исключили происхождение крови
ни от подозреваемого, ни от потерпевшей. В том же духе был сформулирован и общий
вывод по экспертизе, хотя в данном случае подозреваемый исключался по системе
АВО, на основании чего и следовало строить вывод.
Ситуация, когда результаты традиционного исследования и ДНК-анализа не
согласуются между собой, могут не содержать противоречия, поскольку в ходе их
исследуются разные генетические маркеры. Нельзя ожидать и того, что во всех
случаях результаты ДНК-анализа будут более информативными, чем исследование
традиционных маркеров: если типируется малое количество локусов и выявляемые
аллели имеют высокую частоту встречаемости, высокой, соответственно, будет и
вероятность случайного совпадения. Следует, однако, оценивать результаты всех
исследований в комплексе, формулируя выводы таким образом, чтобы они отражали
всю картину в целом.
Если данные ДНК-анализа противоречат результатам исследования традиционных
маркеров, с тем чтобы внести ясность, в некоторых случаях может быть
целесообразным повторно провести некоторые из исследований, выполненных при
первичной экспертизе по традиционным системам. В нашей собственной экспертной
практике был следующий случай (Заключение эксперта № 9530 от 2.02.94 г.),
который нам кажется уместным здесь привести. При проведении назначенной в
качестве дополнительной генотипоскопической экспертизы, в которой мы выполнили
исследование по VNTR-локусам, полученный результат шел вразрез результатам и
выводам первичной экспертизы, выполненной по системе АВО. Учитывая большую
значимость этой экспертизы для следствия, с тем, чтобы разобраться в ситуации,
мы провели тщательное исследование этих объектов также по системе АВО. Результат
его оказался иным, чем тот, который был получен при первичной экспертизе.
Выявленная нами группа крови находилась в соответствии с данными исследования
ДНК. Мы провели также исследование антигенов М и N системы МNSs, которое
послужило еще одним подтверждением полученных нами данных. Таким образом, в
данном случае при первичной экспертизе имела место ошибка (причиной ее, видимо,
являлось то, что объект был сложный, требовалось использование высокоавидных
реагентов, отсутствовавших у эксперта). Согласно УПК, эксперт имеет право
предоставлять дополнительную информацию, если она, по его мнению, может иметь
значение для следствия, и этим правом в соответствующих случаях необходимо
пользоваться.
Выбор стратегии проведения экспертизы во многом определяется ее категорией -
первичной, дополнительной или повторной экспертизы. Отметим, что ни в одном из
постановлений, по которым выполнялись экспертизы, которые мы рецензировали,
категория назначаемой экспертизы не была следователем указана и эксперт, таким
образом, не получал указания, может ли он использовать данные, приведенные в
предыдущих экспертизах (по определению наличия крови, установлению видовой,
половой принадлежности и т.д.), или должен повторять соответствующие
исследования. Экспертизы с использованием методов ДНК-анализа «по умолчанию»
проводятся как дополнительные, однако, без указания категории экспертизы в
постановлении, это может в последующем породить проблемы в суде. Он могут быть
связаны, например, с характером представления в экспертизе данных, что в
зависимости от категории экспертизы может иметь особенности. Так, если
экспертиза, проводимая на основе ДНК-анализа, является дополнительной, то
наличие крови в ней может не устанавливаться. В этом случае, однако, обязательна
ссылка на номер заключения первичной экспертизы, данные которой использованы.
В уже упоминавшейся нами выше экспертизе (выводы которой оказались в
противоречии с выводами предыдущих экспертиз), эксперт, не проводя сам
установление наличия крови, обозначал объект как пятно крови лишь на основании
информации о результатах первичной экспертизы в постановлении следователя.
Следователь не является специалистом в области судебно-медицинской экспертизы, и
поэтому постановление может не содержать точной и полной информации о
результатах предыдущих экспертиз. Как было видно по тексту заключения, в данном
случае эксперт, проводивший ДНК-анализ, с заключением первичной экспертизы не
знакомился (хотя должен был его запросить, даже если оно не было предоставлено
сразу). Объект, о котором шла речь, в действительности фигурировал в первичной
экспертизе не как пятно крови, а как «смешанный» объект – содержащий кровь и
буккальный эпителий. В экспертизе же, выполненной на основе методов анализа ДНК,
этот факт был полностью проигнорирован и не учитывался ни при описании объекта,
ни в исследовании, ни в формулировке выводов.
Вопросы, касающиеся особенностей выполнения экспертиз в зависимости от их
категории и соотнесения полученных при них данных, особенно актуальны для
«проблемных» экспертиз, когда выявляются расхождения в выводах.
В разделе вероятностно-статистического анализа в некоторых заключениях
давалась лишь искомая вероятностная величина, без описания того, каким образом
велись расчеты. Вероятностные расчеты - часть исследования и они должны быть
изложены в заключении, также как другие разделы исследования. Если используется
компьютерная программа по математической обработке генетических данных, на нее
обязательна ссылка и указание, кем и когда она утверждена.
В целом ряде экспертиз не было также указано, какими популяционными данными
пользовался эксперт. Кроме того, отсутствие отечественных популяционных данных в
отношении исследованных локусов и вынужденное использование зарубежных сведений
делало, на наш взгляд, целесообразным в случае выявления редких аллелей,
различия в частотах которых для разных популяций могут быть весьма
значительными, прибегать к консервативному подходу и использовать для этих
аллелей потолочные частоты.
Что касается техники вероятностных расчетов, то к замечаниям можно отнести
выявленные в «ранних» экспертизах некоторые проблемы в случае оценки "смешанных"
следов. Это побудило нас разработать соответствующие методические рекомендации
[51], а также рассмотреть эту тему на Всероссийском семинаре экспертов-биологов
ОВД.
Иногда отмечались неточности, связанные с введением в расчеты информации о
половой принадлежности. При исследовании следов спермы пол идентифицируемого
лица априори известен. Поэтому если в выводах указывалось, что рассчитанная
величина случайного совпадения признаков означает, с какой вероятностью
признаки, согласующиеся с профилем исследуемого объекта, встречаются среди
мужчин, то это уточнение не требовало введения в расчеты коэффициента 0,5
(поскольку среди мужчин анализируемые аллельные варианты встречаются с такой же
частотой, как и в популяции в целом). Иная ситуация имела место, когда пол
идентифицируемого лица был изначально неизвестен и становился дополнительным
диагностическим признаком. В этом случае, определив половую принадлежность
объекта, в расчеты следовало ввести коэффициент 0,5 и соотнести полученную
величину случайного совпадения с населением в целом.
Представление в заключении хода и результатов исследования не всегда
отличалось необходимой полнотой. Например, отсутствовали приложения в виде
фотоматериалов, документирующих результаты экспертизы. В описательной части
исследования в ряде случаев не приводилась такая существенная информация, как
данные об изготовителях тест-систем, о параметрах электрофореза (степень
разгонки), указание которых необходимо для оценки разрешающей способности
использованной в исследовании электрофоретической системы (особое значение это
имеет для STR-анализа), и др.
Замечания редакционного характера касались, в частности, использования
терминологии. Например, не являлось удачным употребление термина "генотип"
применительно к генетической характеристике, выявленной при исследовании
объекта, содержащего ДНК неизвестного происхождения.
Выводы по экспертизе. Сложность и неоднозначность результатов, которые могут
иметь место при экспертном исследовании, в ряде случаев стали причиной того, что
эксперт, обсуждая различные стороны исследования, формулировал окончательный
вывод по экспертизе таким образом, что не давал четкого ответа на вопрос,
поставленный на разрешение экспертизы. Например, в одном из заключений так и
осталось не вполне ясно, могла ли все-таки кровь, обнаруженная на одежде
обвиняемого, произойти от потерпевшей или нет.
Необоснованный вывод о причине отрицательного результата ПЦР фигурировал в
целом ряде заключений. Например, эксперт объяснял отрицательный результат
типирования малым исходным количеством материала, делая такой вывод (в
категорической форме) лишь на основании размеров пятна, не имея другой
аргументации, в том числе, результата количественного определения выделенной
ДНК. Размеры пятна, даже если они малы, сами по себе, не могут служить
основанием для того, чтобы с уверенностью относить отрицательный результат ПЦР
за счет малого количества материала: ПЦР очень чувствительна и пригодна для
исследования микрообъектов. Поэтому, если не было определено количество
выделенной ДНК и не исключены иные возможные причины отрицательного результата
(деградация ДНК, ингибирование реакции), такой вывод не является правомерным.
Рекомендации по совершенствованию экспертной работы
Регулярный анализ экспертной практики должен являться неотъемлемой частью
процесса совершенствования экспертной работы. Целесообразно, на наш взгляд,
ввести практику ежемесячного рецензирования заключений центральным экспертным
учреждением ведомства. Это позволит осуществлять более эффективный контроль
экспертной работы, что особенно важно на этапе становления метода. В отношении
вновь сформированных экспертных лабораторий, в штате которых еще отсутствуют
эксперты, имеющие достаточный опыт работы в области ДНК-идентификации и
исследование выполняется начинающими специалистами, представляется
целесообразным проверка экспертиз еще на этапе оформления заключения, до
отправления его лицу, назначившему экспертизу. При современных средствах
коммуникации оперативная передача такой информации не является проблемой,
осуществим контроль «в реальном времени». Например, с помощью электронной почты
возможна проверка экспертизы в тот же день, причем с помощью передачи
графических файлов могут быть изучены и первичные материалы.
Что касается совершенствования системы проведения стажировок, то
целесообразно изыскать возможности для организации более продолжительных курсов
обучения. Это позволит не только более полно изучать теоретические и
практические аспекты исследования, но и даст возможность приобретения на
стажировках определенного экспертного опыта. Целесообразно участие стажеров в
проведении экспертиз, наблюдение за ходом их производства, самостоятельное
выполнение тех или иных этапов или, под контролем обучающего, всей экспертизы в
целом, составление заключений.
4.2. Разработка «Унифицированной программы последипломного обучения врачей
по судебно-медицинской экспертизе» (применительно к ДНК-идентификации)
В судебно-медицинской службе Минздрава РФ подготовка по экспертизе
вещественных доказательств и другим разделам судебной медицины регламентируется
«Унифицированной программой последипломного обучения врачей по судебной
медицине», утвержденной МЗ РФ. В дополнение к части 2 этой программы –
«Судебно-медицинская экспертиза вещественных доказательств» - был разработан
(совместно с проф. Солохиным А.А. и проф. Томилиным В.В.) отсутствующий в
настоящее время раздел, посвященный ДНК-идентификации.
Составленная программа по ДНК-идентификации охватывает весь объем
теоретических знаний и практических навыков, необходимых для работы по данному
направлению. В соответствии с принятой схемой построения учебных программ
последипломного обучения врачей, программа составлена по блочной системе, где
блок называется курсом. Курс разделен на разделы, разделы - на темы, темы – на
элементы.
Программа включает в себя 4 курса, учебные планы циклов профессиональной
переподготовки, общего и тематического усовершенствования, а также список
рекомендуемой литературы. Курсы являются общими для всех циклов, однако круг
вопросов, которые рассматриваются в рамках каждого раздела и темы, также как
соответствующий объем материала, для разных циклов неодинаковы. Это находит
отражение в учебных планах циклов, а в дальнейшем – при разработке планов
занятий.
Задачи и содержание циклов: специализации, общего и тематического
усовершенствования
Цикл профессиональной переподготовки «Судебно-медицинская экспертиза,
проводимая с использованием методов анализа ДНК» предназначен для
судебно-медицинских экспертов, имеющих подготовку и опыт работы в области
судебно-медицинской экспертизы вещественных доказательств, для освоения ими
комплекса теоретических знаний и практических навыков, необходимых для
самостоятельного проведения экспертиз с использованием методов анализа ДНК. Цикл
имеет принятую для циклов специализации продолжительность и рассчитан на 576 ч
(4 мес.) занятий.
Цикл общего усовершенствования «Современные концепции и технологии
ДНК-идентификации», рассчитанный на 216 ч (1,5 мес.) занятий, имеет своей целью
повышение квалификации экспертов, прошедших ранее специализацию по
судебно-медицинской ДНК-идентификации и работающих по данному направлению. На
этом цикле, содержание которого будет постоянно обновляться в соответствии с
развитием науки и технологии, предполагается освещать характерное для данного
периода времени состояние ДНК-идентификации, рассматривая его в комплексе. При
регулярном прохождении таких циклов (например, раз в 3-4 года) у специалистов
будет создаваться целостное представление о современных возможностях, концепциях
и тенденциях развития данного направления. Такие циклы необходимы также для
того, чтобы освежить знания экспертов по наиболее важным теоретическим разделам
и преодолеть характерную для практики проблему: занимаясь рутинной работой,
эксперты постепенно забывают теоретические основы. Это приводит к тому, что
эксперт иногда воспроизводит методику чисто технически, не вникая должным
образом в те процессы, которые лежат в основе данного метода. Это сказывается на
уровне и качестве исследования.
Циклы тематического усовершенствования, общее название которых «Новое в
ДНК-идентификации», предназначены для обучения судебно-медицинских экспертов
методам ДНК-идентификации по узким проблемам с учетом последних достижений в
этой области. Продолжительность их 144 ч, или 1 месяц занятий. Содержание циклов
может быть различным. Например, цикл может быть посвящен освоению новых методов
выделения и очистки ДНК, исследования новой группы локусов или нового метода
исследования уже известных локусов и т.д. Изложение теоретических основ данного
метода и получение практических навыков будут являться основной задачей и
занимать большую часть времени цикла. Целесообразно также, чтобы стажеры
получили и общее представление о том новом, что появилось за последнее время.
Для этого в очень краткой форме давать характеристику общего состояния
ДНК-идентификации. Более короткие циклы (продолжительностью 72 ч, или 2 недели
занятий) будут отведены для изучения вопросов, не требующих длительного
обучения, – например, освоения какой-либо конкретной лабораторной процедуры,
новой компьютерной программы и т.д. В этих случаях обучение будет строго
ориентировано на тематику цикла, без отведения времени на иные темы.
В программу включен также тематический декадник (72 ч, или 2 недели занятий)
«Применение методов ДНК-анализа в судебно-медицинской экспертизе». Он
предназначен для судебно-медицинских экспертов, работающих в области
судебно-медицинского исследования вещественных доказательств, но не занимающихся
самостоятельным производством экспертиз с использованием методов ДНК-анализа, а
также для руководителей отделений судебно-медицинского исследования вещественных
доказательств бюро СМЭ (или руководителей иных уровней). Обучение по программе
этого цикла может вестись как в качестве отдельного цикла, так и служить
дополнением к циклам тематического усовершенствования или специализации по
судебно-медицинской экспертизе вещественных доказательств. Целью этого цикла
является повышение образовательного уровня экспертов и руководителей, получение
знаний для грамотной организации и проведения исследования судебно-медицинских
объектов с учетом существования данного направления экспертизы, а также для
использования этих знаний при организации лабораторий судебно-медицинского
ДНК-анализа. В настоящее время методы исследования ДНК стали неотъемлемой частью
экспертизы вещественных доказательств и спорного отцовства, поэтому без
осведомленности в этой области нельзя говорить о полноте знаний эксперта и
руководителя. Принципиальная возможность проведения исследования методами
анализа ДНК должна учитываться при выборе оптимальной стратегии экспертизы. Так,
при малом количестве материала, с тем чтобы обеспечить экономное его
расходование, эксперту, возможно, следует отказаться от применения каких-то
менее информативных методов исследования в пользу более информативного
ДНК-анализа. Это может быть целесообразно, в том числе, и в тех случаях, если в
учреждении ДНК-анализ не используется: после проведения первичных этапов
исследования вещественные доказательства могут быть направлены в одно из
учреждений, имеющих соответствующую лабораторию. Кроме того, если в дальнейшем
будет проводиться ДНК-анализ, это должно учитываться при манипуляциях с
биологическим материалом на предшествующих ему этапах традиционной экспертизы.
Например, широко используемый метод предварительного исследования вещественных
доказательств - осмотр в ультрафиолетовых лучах - должен выполняться с
осторожностью и предусматривать лишь кратковременные экспозиции: УФЛ вызывает
деградацию ДНК и может отрицательно сказываться на результатах экспертизы.
Содержание учебных курсов
Курс I - "Организационные принципы экспертизы, проводимой с использованием
методов анализа ДНК" - посвящен изучению общих положений экспертизы,
рассмотрению места ДНК-анализа в комплексе экспертных исследований, характера
ставящихся перед экспертом вопросов, процессуальных, правовых и организационных
аспектов данного исследования, вопросы формирования и функционирования
лаборатории судебно-медицинского ДНК-анализа и т.д. Разделы курса: «Общие
положения экспертизы, выполняемой с использованием методов ДНК-анализа»,
«Порядок работы лаборатории судебно-медицинского ДНК-анализа»,
«Материально-техническая база лаборатории ДНК-анализа».
Курс II - "Молекулярно-генетические основы ДНК-идентификации" – предназначен
для изучения теоретического базиса ДНК-идентификации, подготовки обучающегося к
освоению методов исследования. Курс составлен таким образом, чтобы преломить
прикладные проблемы судебно-медицинского ДНК-анализа через призму
фундаментальных основ генетики. Он ориентирован на те вопросы молекулярной
генетики, которые имеют непосредственное отношение к применению ее методов в
судебной медицине (полиморфизм ДНК, локусы, исследуемые с идентификационной
целью, и т.д.).
Курс III - "Проведение судебно-медицинской экспертизы с использованием
методов ДНК-анализа". Раздел 1 - "История развития ДНК-идентификации". Раздел 2
- "Современное состояние проблемы ДНК-идентификации в судебной медицине". Раздел
3 ("Этапы проведения экспертизы, предшествующие ДНК-анализу") важен для
формирования общего плана проведения экспертизы, с самых первых ее этапов, и
определения последовательности экспертных действий, с учетом категории
экспертизы, исходных данных и получаемых результатов. В разделе 4 ("Этапы
ДНК-анализа") рассматриваются теоретические и практические аспекты технологии
анализа ДНК. Первые три темы раздела относятся к процедуре пробоподготовки
материала. Тема "ПДРФ-анализ" в учебных планах представлена как теоретическая.
Тема "Полимеразная цепная реакция" обсуждается во всех подробностях теории и
практического применения, т.к. на этой технологии основана современная
ДНК-идентификация. Тема "Разделение фрагментов ДНК с помощью электрофореза"
посвящена изучению общей теории электрофореза и используемых методов. Учитывая
отсутствие в настоящее время приборной базы для применения автоматизированных
методов электрофореза в подавляющем большинстве лабораторий ДНК-анализа
экспертной службы, в процессе специализации целесообразно практическое освоение
только в отношении ручных вариантов методов электрофореза, автоматизированные же
методы (капиллярный электрофорез, метод с использованием секвенатора) изучаются
пока только теоретически. При актуальности их практического освоения этим
методам следует посвятить циклы тематического усовершенствования. Раздел 5
("Судебно-медицинское исследование полиморфных локусов с помощью методов
ПЦР-анализа") включает в себя рассмотрение теоретических основ и освоение
практических навыков исследования полиморфизма ядерной ДНК. Полиморфизм
митохондриальной ДНК в цикле специализации предполагается пока изучать только
теоретически; при необходимости практического освоения методов эту тему
целесообразно ввести как цикл тематического усовершенствования. Раздел 6 -
"Диагностика пола при судебно-медицинском исследовании биологических объектов".
Раздел 7 ("Особенности исследования экспертного материала") посвящен изучению
методических подходов к исследованию малых количеств ДНК, гетерогенных объектов,
деградированной ДНК, следов с загрязнениями, а также оценки данных их
исследования. Раздел 8 - "Информационные поисковые системы ДНК-регистрации для
расследования преступлений".
Курс IY - "Использование данных популяционной генетики и
вероятностно-статистического анализа для интерпретации результатов
ДНК-идентификации" - состоит из двух частей. Первая (разделы 1-4: «Понятия
популяционной генетики», «Статистические методы популяционной генетики»,
«Популяционные различия частот в полиаллельных локусах», «Популяционная генетика
полиморфных локусов, изучаемых при судебно-медицинской идентификации») посвящена
популяционным аспектам ДНК-идентификации. Содержание второй части курса
-прикладные аспекты теории вероятностей и математической статистики (разделы
5-10: "Понятия теории вероятностей применительно к проблемам ДНК-идентификации",
"Методы математической статистики, используемые в ДНК-идентификации",
"Вероятностные характеристики идентификации", "Математические модели,
используемые в ДНК-идентификации и соответствующие им алгоритмы вероятностных
расчетов", "Проблема позитивной идентификации", "Представление вероятностных
расчетов в Заключении эксперта". Вопросы, связанные с составлением выводов и
оформлением Заключения эксперта в целом, рассматриваются в разделе 11.
Контингент обучающихся
Адекватным базовым образованием для работы в области судебно-медицинской
ДНК-идентификации является высшее медицинское или биологическое образование. Для
получения права на деятельность в области судебно-медицинской ДНК-идентификации
необходимо прохождение экспертом цикла специализации. Контингент экспертов для
обучения на разных циклах указан в проекте Программы.
Помимо специальной подготовки, эксперт должен, на наш взгляд, владеть и
некоторыми другими знаниями. Так, для полноценной работы необходимо хорошее
знание английского языка, на котором публикуется не только большая часть научных
работ по ДНК-идентификации, но и инструкций и методических разработок
изготовителей оборудования и реактивов. Работа на современном уровне требует
также хорошего знания компьютера, умения работать в Интернете.
Преподавательский состав
Содержание программы и структура циклов показывают, какие требования должны
предъявляться к образовательному и профессиональному уровню преподавательских
кадров. Рассмотрим каждый курс в отдельности.
Курс I. Имеет сугубо судебно-медицинское содержание и должен вестись
специалистом в области судебной медицины.
Курс II. Задача обучения этому курсу, принципиально, может быть решена
специалистом в области судебной медицины, хорошо подготовленным по
фундаментальным теоретическим вопросам молекулярной генетики. Тем не менее,
более целесообразно ведение этого курса генетиками, профессионально
занимающимися вопросами, указанными в содержании программы. Эти специалисты, в
свою очередь, должны быть хорошо осведомлены в содержании предмета
судебно-медицинской ДНК-идентификации, с тем чтобы, в условиях дефицита времени,
построить обучение таким образом, чтобы оно охватило все важные для работы
эксперта вопросы и, в то же время, не перегрузило программу информацией, без
которой эксперт может обойтись.
Курс III. Прикладное, судебно-медицинское содержание курса обусловливает
необходимость ведения его, в целом, судебными медиками – специалистами в области
ДНК-идентификации. На этапах обучения возможно и целесообразно участие
молекулярных генетиков.
Курс IY. К обучению этому курсу необходимо привлекать профессионалов в
области популяционной генетики, теории вероятностей и математической статистики,
компетентных в области ДНК-идентификации.
Таким образом, поскольку ДНК-идентификация является разделом
судебно-медицинской экспертизы, преподавание, в целом, должно вестись судебными
медиками (специализирующимися в области ДНК-идентификации). В то же время,
учитывая, что это направление находится на стыке судебной медицины с целым рядом
наук (молекулярной и популяционной генетики, высшей математики), в преподавании
целесообразно, а в ряде случаев и необходимо участие специалистов в
соответствующих областях знаний. Все они должны быть компетентны в области
ДНК-идентификации.
Проблема обеспечения учебного процесса необходимыми кадрами весьма сложна.
Учитывая большой кадровый дефицит, на наш взгляд, проблему обучения по
ДНК-идентификации следует рассматривать применительно ко всей экспертной службе,
а не к определенным ведомствам. Целесообразно создать единую систему обучения
для всех ведомств, в рамках которых проводятся экспертизы с использованием
методов анализа ДНК (МВД, Минздрава, МО, ФСБ), сформировав единый
профессорско-преподавательский состав за счет ведущих специалистов страны. Без
этого вряд ли можно решить на должном уровне данную проблему для всех ведомств.
Список литературы
- Wyman A., White R. A highly polymorphic locus in human DNA // Proc. Natl.
Acad. Sci. USA, 1980. - V.77. - P. 6754-6758.
- Bell G.I., Selby M.J., Rutter W.J. The highly polymorphic region near the
human insulin gene is composed of simple tandemly repeating sequences //
Nature, 1982. - V. 295. - P. 31-35.
- Jeffreys A.J., Wilson V., Thein S.L. Hypervariable minisatellite regions
in human DNA // Nature, 1985. – V. 314. – P. 67-73.
- Jeffreys A.J., Wilson V., Thein S.L. Individual-specific “fingerprints” of
human DNA // Nature, 1985. – V. 316. – P. 76-79.
- Рогаев Е.И. Высоконестабильная последовательность генома TVRI-6 имеет
область, сходную с участками ДНК, ответственными за генетические перестройки в
прокариотических системах // Тезисы докладов конференции “Генетика и биохимия
микроорганизмов – биотехнологии”.Москва,1986.-С. 81.
- Vassart G., Georges M., Monsieur R. et al. A sequence in M13 phage detects
hypervariable minisatellites in human and animal DNA // Science, 1987. – V.
235. – P. 683-684.
- Джинчарадзе А.Г., Иванов П.Л., Рысков А.П. Геномная «дактилоскопия».
Характеристика клонированной последовательности JIN 600 генома человека,
обладающей в составе вектора М13 свойствами высокополиморфного маркера ДНК //
Докл. Акад. наук СССР. 1987/ - T. 295. - № 1. – С. 230-234.
- Gill P., Jeffreys A.J., Werett D.J. Forensic application of
DNA-“fingerprins” // Nature, 1985. - V. 318. - P. 577-579.
- Рогаев Е.И. Экспериментальный поиск и молекулярно-генетический анализ
повторяющихся последовательностей ДНК, нестабильных в геноме человека //
Автореферат дисс. канд. биол. наук. 1988.
- Иванов П.Л., Гуртовая С.В., Плаксин В.О. и др. «Геномная дактилоскопия» с
использованием в качестве зонда бактериофага М13 (экспертиза вещественных
доказательств и идентификация личности) // Суд.-мед. экспертиза, 1989. - № 4.
С. 39-42.
- Стегнова Т.В., Рогаев Е.И., Иоанесян Л.С. и др. Исследование крови
человека методом генотипоскопии (ДНК-дактилоскопия) // Методические
рекомендации. М. МВД РФ. 1991.
- Nosikov V.V., Ovchinnikov I.V., Gavrilov D.K., Chelnokova M.V. Genetic
analysis of some human VNTR loci by means of the PCR technique for paternity
testing // Abstracts of 23d Annual Meeting of European Society of Human
Genetics, Leuven, 1991. – P. 179.
- Singer-Sam J., Tanguay R.L., Riggs A.D. Use of Chelex to improve signal
from small number of cells // Amplifications: a forum for PCR Users, 1989. – N.
3.–P. 11.
- Стегнова Т.В., Перепечина И.О., Пименов М.Г., Сыроквашева Е.Ю.
Исследование спермы при идентификации личности методом генотипоскопии. //
Методические рекомендации: М., ЭКЦ МВД РФ, 1993. – 24 с.
- Перепечина И.О., Стегнова Т.В., Пименов М.Г. Исследование объектов
судебно-биологической экспертизы полимеразной цепной реакцией. // Методические
рекомендации: М., ЭКЦ МВД РФ, 1996. – 24 с.
- Перепечина И.О. Тялина Ю.Ю. Исследование ДНК, подвергшейся выраженной
деградации. // Методические рекомендации: М., ЭКЦ МВД РФ, 1999. – 32 с.
- Erlich H.A., Gelfand D.H., Saiki R.K. Specific DNA amplification // Nature,
1988. - V. 331. - P. 461-462.
- Erlich H.A., Gelfand D.H., Saiki R.K. Specific DNA amplification // Nature,
1988. - V. 331. - P. 461-462.
- Jeffreys A.J., Wilson V., Neumann R., Keyte J. Amplification of human
minisatellites by the polymerase chain reacrion: towards DNA fingerprinting of
single cells // NAR, 1988. – V. 16. – P. 10953-10953.
- Horn G.T., Richards B., Klinger K.W. Amplification of a highly polymorphic
VNTR segment by the polymerase chain reaction // NAR, 1989. – V. 17. – P.
2140.
- Odelberg S.J., Plaetke R., Eldridge J.R. et al. Characterisation of of
eight VNTR loci by agarose gel electrophoresis // Genomics, 1989. – V. 5. – P.
915-924.
- Kasai K., Nakamura Y., White R. Amplificayion of a variable number of
tandem repeats (VNTR) locus (pMCT 118) by the polymerase chain reaction (PCR)
and its application to forensic science // J. For. Sci., 1990. – V. 35. – N.
5. – P. 1196-1200.
- Decorte R., Hilliker C., Marynen P., Cassiman J.-J. Rapid and simple
detection of minisatellite regions in forensic DNA samples by the polymerase
chain reaction combined with a chemiluminescence method//Trends Genet.,1990. -V.
6.-P.172-173.
- Reynold R., Sensabaugh G. Analysis of genetic markers in forensic DNA
samples using the polymerase chain reaction // Analytical chemistry, 1991. -
V.63. - N. 1. – P. 2-15.
- DNA technology in forensic science // National Research Council. National
Academy Press. Washington, DC, USA, 1992.
- The evaluation of forensic DNA evidence // National Research Council.
National Academy Press. Washington, DC, USA, 1996.
- Использование индивидуализирующих систем на основе полиморфизма длины
амплифицированных фрагментов (ПДАФ) ДНК в судебно-медицинской экспертизе
идентификации личности и установления родства // Методические указания МЗ РФ №
98/253 (утверждены 19.01.1999 г.).
- Nakahori Y., Hamano K., Iwaya M., Nakagome Y. Sex identification by
polymerase chain reaction using X-Y homologous primers // Am. J. Med. Genet.,
1991. - V.39. – P. 472-473.
- Перепечина И.О. Новый метод установления половой принадлежности объектов
биологического происхождения. // Экспертная практика, 1992. - № 33. - С.
35-38.
- Перепечина И.О., Стегнова Т.В. Установление половой принадлежности крови
полимеразной цепной реакцией. // Методические рекомендации: М., ЭКЦ МВД РФ,
1995. – 16 с.
- Manucci A., Sullivan K.M., Ivanov P.L., Gill P. Forensic application s of
a rapid and quantitative DNA sex test by amplification of the X-Y homologous
gene amelogenin // Int. J. Leg. Med., 1994. – V. 106. – P. 190.
- Del Rio S.A., Marino M.A., Belgrader P. PCR-Based human leukocyte antigen
(HLA) DQa typing of blood stained light and dark blue denim fabric // J. For.
Sci., 1996. – V. 41. - N. 3. – P. 490-492.
- Witt M., Erickson R.P. A rapid method for the detection of Y-chromosomal
DNA from dried blood specimens by the polymerase chain reaction // Hum. Genet.,
1989. – V. 82. – P. 271-274.
- Roffey P.E., Eckhoff C.I., Kuhl J.L. A rare mutation in the amelogenin
gene and its potential investigative ramifications // J. For. Sci., 2000. – V.
45. – N. 5. – P. 1016-1019.
- Keohavong P., Thilly W.G. Fidelity of DNA polymerases in DNA amplification
// Proc. Natl. Acad. Sci. USA., 1989. – V. 86. – P. 9253-0257.
- Ivey J.N., Atchinson B.A., Georgalis A.M. Assessment of PCR of the D17S30
locus for forensic identification // J. For. Sci., 1994. – V. 39. – P. 52-63.
- Перепечина И.О., Стегнова Т.В., Пименов М.Г. Использование методов
генетического анализа для исследования объектов экспертизы вещественных
доказательств. // Экспертная практика, 1994. - № 35. - С. 58-62.
- Перепечина И.О., Пименов М.Г. ДНК-анализ в криминалистических
исследованиях органов внутренних дел России. // Национальное Центральное бюро
Интерпола в Российской Федерации: Информационный сборник. 1996. – № 19. - С.
58-60.
- Овчинников И.В. Исследование аллельного полиморфизма генов и определение
пола методом амплификации ДНК // Автореферат дисс. канд. биол. наук. 1993.
- Чистяков Д.А., Гаврилов Д.К., Овчинников И.В., Носиков В.В. Анализ
распределения аллелей четырех гипервариабельных тандемных повторов среди
неродственных представителей русской нации, проживающих в Москве, с помощью
полимеразной цепной реакции // Молекулярная биология, 1993. - Т. 27. - Вып. 6.
- С. 1304-1314.
- Заякин О.Б. Внедрение в практическую работу экспертно-криминалистических
подразделений новых видов экспертиз // Экспертная практика, 1996. - С.58-60.
- Перепечина И.О., Усачева Л.Л. Идентификация неопознанных лиц по их
останкам методами анализа ДНК. // “Современные вопросы судебной медицины”. Сб.
научн. трудов. Владивосток, 2001. – С. 161-165.
- Gill P., Sparkes R., Kimpton C. Development of guidelines to designate
alleles using an STR multiplex system // For. Sci. Int., 1997. - V. 89. - P.
185–197.
- Исаенко М.В. Изучение возможностей молекулярно-генетических
индивидуализирующих систем в судебно-медицинском анализе объектов смешанной
природы // Дисс.…канд. мед.наук.М., 2000.
- Рогаев Е.И. Выявление гипервариабельных участков генома и поиск
генетических локусов наследственных болезней человека //Дисс. докт. биол.
наук. 1996.
- Фогель Ф.,Мотульски А. Генетика человека//М.,«Мир».Пер. с англ. 1989,
1990.
- Статистическая дактилоскопия. Методологические проблемы // Под ред. Л.Г.
Эджубова. М. - 1999.
- 48.Перепечина И.О. Проблема оценки данных ДНК-идентификации с точки
- зрения последствий ошибок первого и второго рода. // “Современные вопросы
- судебной медицины”. Сб. научн. трудов. Владивосток, 2001. – С. 173-176.
- Перепечина И.О., Гришечкин С.А. Вероятностные расчеты в ДНК-дактилоскопии.
// Методические рекомендации: М., ЭКЦ МВД РФ, 1996.– 16 с.
- Перепечина И.О., Гришечкин С.А. Экспертная оценка и математическая
обработка результатов исследования объектов, содержащих ДНК двух и более лиц.
// Методические рекомендации: М., ЭКЦ МВД РФ, 1997. – 24 с.
- Oz C., Zamir A. An evaluation of the relevance of routine DNA typing of
fingernail clippings for forensic casework // J. For. Sci., 2000. – V. 45. – N.
1. – P. 158-160.
- Tanaka M., Yoshimoto T., Nozawa H. et al. Usefulness of a toothbrush as a
source of evidential DNA for typing // J. For. Sci., 2000. – V. 45. – N. 3. –
P. 674-676.
- Herber B., Herold K. DNA typing of human dandruff // J. For. Sci., 1998. –
V. 43. – N. 3. – P. 648-656.
- Weir B.S. Are DNA profiles unique? // 8th International Symposium on Human
Identification. Promega Corporation, 1997.
- Statistical and population genetics issues affecting the evaluation of the
frequency of occurence of DNA profiles calculated from pertinent database(s)
// DNA Advisory Board. Forensic Science Communications, 2000. – V. 2. – N. 3.
- Taroni F., Lambert J., Fereday L., Werrett D. Evaluation and presentation
of forensic DNA evidence in European laboratories // 7th ENFSI DNA Working
Group Meeeting, 1998.
- Перепечина И.О., Пименов М.Г. Кондрашов С.А. Особенности формирования базы
данных о генетических признаках на основе автоматизированных информационных
систем. // Экспертная практика, 1996. - № 40. - С. 3-5.
- Перепечина И.О. Проблемы создания баз данных о признаках ДНК и возможности
их использования уже на начальных стадиях расследования преступлений. // Сб.
научных трудов: М., ВНИИ МВД РФ, 1998. – С. 32-38.
- О возможностях использования банка ДНК при расследовании половых
преступлений. // Информационное письмо (авторы: Пименов М.Г., Перепечина
И.О.): М., ЭКЦ МВД РФ, 1995.–4 с.
- Формирование банка ДНК биологических объектов, изъятых с мест нераскрытых
преступлений. // Методические рекомендации (авторы: Перепечина И.О., Пименов
М.Г.,Кондрашов С.А.):М.,ЭКЦ МВД РФ,1996.– 4 с.
- Перепечина И.О., Пименов М.Г., Кондрашов С.А. Программа исследования ДНК
при формировании базы данных. // Вопросы криминалистики и
экспертно-криминалистические проблемы. Сб. научных трудов: М., ЭКЦ МВД РФ,
1997. – С. 66-71.
- Koutny L., Schmalzing D., Adoutian A. et al. High speed STR analysis on
microfabricated electrophoretic devices // 9th International Symposium on
human identification. Promega Corporation, 1998.
- Devaney J. Short tandem repeat analysis using high performance liquid
chromatography // 10th International Symposium on human identification.
Promega Corporation, 1999.
Продолжение следует
Контактный телефон:
7 (095) 254-59-31 (раб.)
E-mail: smi-100@mail.ru
Перепечина Ирина Олеговна
Copyright © 1994-2016 ООО "К-Пресс"
